



1、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤
在一项非对照试验和五项随机对照试验中,对伊布替尼(亿珂、ibrutinib)在CLL/SLL患者中的安全性和疗效进行了论证。
1)研究1102
研究1102 (NCT01105247)是一项开放标签、多中心试验,在48名之前接受过治疗的CLL患者中进行。伊布替尼(亿珂、ibrutinib)口服给药,每日一次,每次420毫克,直至疾病进展或出现不可接受的毒性。由独立审查委员会使用CLL标准国际研讨会的修订版评估ORR和DOR。
中位年龄为67岁(范围为37至82岁),71%为男性,94%为白人。所有患者的基线ECOG表现状态均为0或1。自诊断以来的中位时间为80个月,先前治疗的中位次数为4次(范围为1至12次治疗)。基线时,46%的受试者至少有一个肿瘤大于等于5厘米。
ORR为58.3% (95% CI: 43.2%,72.4%),全部为部分缓解。所有患者均无完全缓解。DOR时间为5.6至24.2个多月。未达到中位DOR。
2)RESONATE
RESONATE研究是一项随机、多中心、非盲、3期伊布替尼(亿珂、ibrutinib)与ofatumumab对比研究(NCT01578707),在既往接受过CLL或SLL治疗的患者中进行。患者(n=391)按1:1的比例随机接受伊布替尼(亿珂、ibrutinib) 420毫克,每日一次,直至疾病进展,或接受不可接受的毒性治疗或接受tumama(初始剂量为300毫克)治疗,一周后接受2000毫克,每周一次的治疗,共7剂,之后每4周一次,共4剂。57名随机分配接受ofatumumab治疗的患者在进展后交叉接受伊布替尼(亿珂、ibrutinib)治疗。
中位年龄为67岁(范围:30至88岁),68%为男性,90%为白人。所有患者的基线ECOG表现状态均为0或1。该试验纳入了373名CLL病患者和18名SLL病患者。自诊断以来的中位时间为91个月,先前治疗的中位次数为2次(范围为1至13次治疗)。基线时,58%的患者至少有一个肿瘤大于等于5厘米。32%的患者伴有17p缺失。
RESONATE的疗效结果见下表,根据IWCLL标准由IRC评估的PFS和OS的Kaplan-Meier曲线分别见下图。
表:RESONATE研究中CLL/SLL病患者的疗效结果
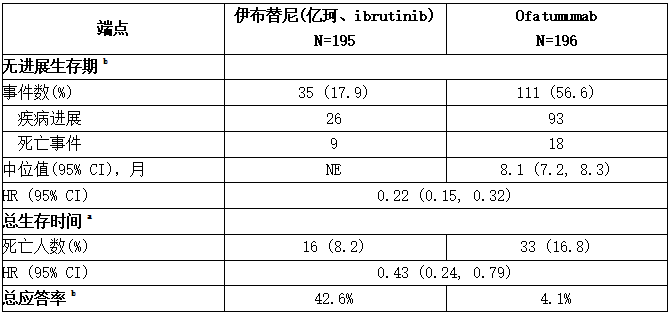
a 中位OS不可对任一组进行评估。
b IRC评估。所有部分缓解均达到;没有一个患者获得完全缓解。
CI =置信区间;HR =危险比;NE =不可评估
图:RESONATE研究中CLL/SLL患者无进展生存期的Kaplan-Meier曲线(ITT人群)
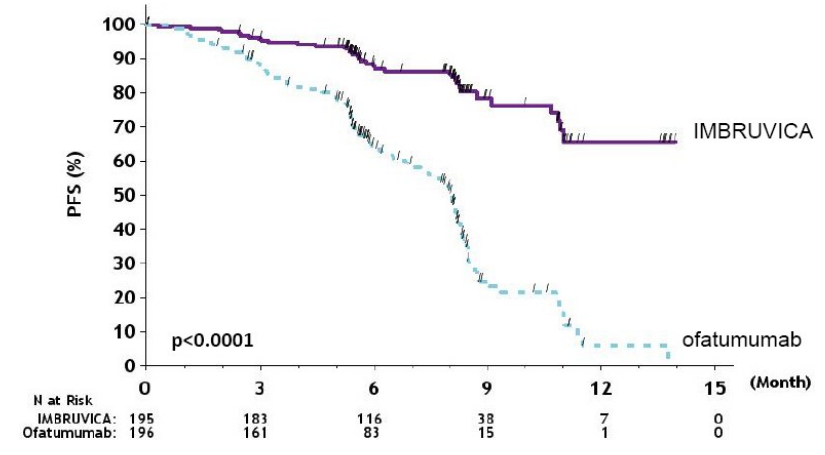
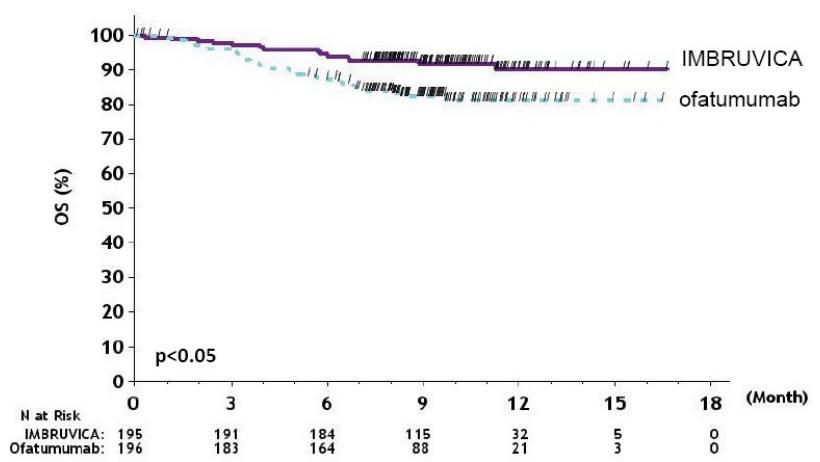
图:RESONATE研究中CLL/SLL患者总生存期的Kaplan-Meier曲线(ITT人群)
63个月随访
总体随访63个月,伊布替尼(亿珂、ibrutinib)组按照IWCLL标准评估的PFS中位值为44.1个月[95% CI (38.5,56.9)],ofatumumab组为8.1个月[95% CI (7.8,8.3)]。研究者评估的伊布替尼(亿珂、ibrutinib)组的总有效率为87.2%,ofatumumab组为22.4%。
3)RESONATE研究中伴有17p缺失的 CLL/SLL(17p缺失的 CLL/SLL)
RESONATE研究中包括127例伴有17p缺失的CLL/SLL患者。中位年龄为67岁(范围为30至84岁),62%为男性,88%为白人。所有患者的基线ECOG表现状态均为0或1。PFS和ORR由IRC进行评估。伴有17p确实的CLL/SLL患者的疗效结果见下表。
表:RESONATE研究中对伴有17p缺失的CLL/SLL患者的疗效结果
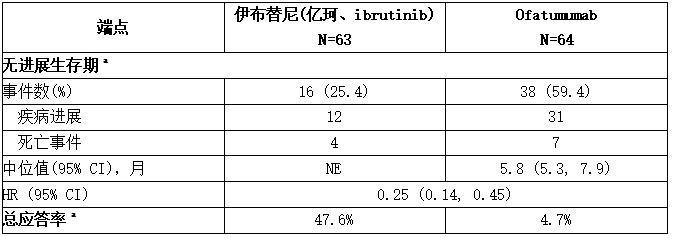
a IRC评估。所有部分缓解均达到;没有一个患者获得完全缓解。
CI =置信区间;HR =危险比;NE =不可评估。
63个月随访
总体随访63个月,伊布替尼(亿珂、ibrutinib)组伴有17p的患者按照IWCLL标准评估的PFS中位值为40.6个月[95% CI (25.4,44.6)],并且ofatumumab组6.2个月[95% CI (4.6,8.1)]。研究者评估的伴有17p的患者的总有效率伊布替尼(亿珂、ibrutinib)组为88.9%,ofatumumab组为18.8%。
4)RESONATE-2
RESONATE-2研究是一项随机、多中心、开放标签的关于伊布替尼(亿珂、ibrutinib)与苯丁酸氮芥(NCT01722487)的3期研究,在接受治疗的天真的CLL或SLL患者中进行,年龄在65岁或以上。患者(n = 269)按1:1随机分配,每日服用伊布替尼(亿珂、ibrutinib) 420毫克,直至疾病进展或出现不可接受的毒性;或在每个28天周期的第1天和第15天服用开始剂量为0.5毫克/千克的苯丁酸氮芥,最多12个周期,根据耐受性允许患者接受最多0.8毫克/千克的住院剂量增加。
中位年龄为73岁(65至90岁不等),63%为男性,91%为白人。91%的患者ECOG基线表现为0或1,9%的患者41ECOG表现为2。
该试验纳入了249名CLL病患者和20名SLL病患者。基线时,20%的患者伴有11q缺失。开始CLL治疗的最常见原因包括:进行性骨髓衰竭,表现为贫血和/或血小板减少(38%)、进行性或症状性淋巴结病(37%)、进行性或症状性脾肿大(30%)、疲劳(27%)和盗汗(25%)。
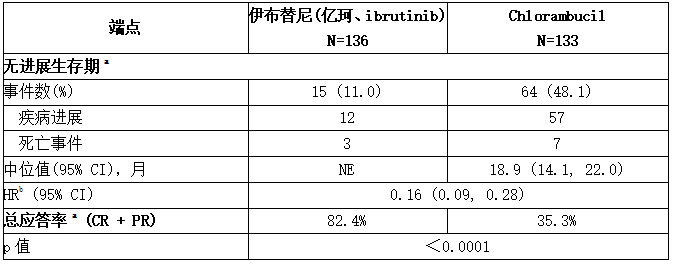
中位随访时间为28.1个月,观察到32例死亡事件伊布替尼(亿珂、ibrutinib)和苯丁酸氮芥治疗组分别为11例(8.1%)和21例(15.8%)。由于41%的患者从苯丁酸氮芥转换为伊布替尼(亿珂、ibrutinib),ITT患者人群的总体生存期分析得出具有统计学意义的HR0.44 [95% CI (0.21,0.92)],并且伊布替尼(亿珂、ibrutinib)组和苯丁酸氮芥组的2年生存率估计值分别为94.7% [95% CI (89.1,97.4)]和84.3% [95% CI (76.7,89.6)]。RESONATE-2的疗效结果见下表以及由IRC根据IWCLL标准评估的PFS的Kaplan-Meier曲线,如下图所示。
表:RESONATE-2中CLL/SLL病患者的疗效结果
a IRC评估;伊布替尼(亿珂、ibrutinib)组5名受试者(3.7%)和Chlorambucil组2名受试者(1.5%)获得完全缓解。
b HR =危险比;NE =不可评估。
图:RESONATE-2研究中CLL/SLL患者无进展生存期的Kaplan-Meier曲线(ITT群体)
55个月随访
总体随访55个月,伊布替尼(亿珂、ibrutinib)组未达到中位PFS。
5)HELIOS
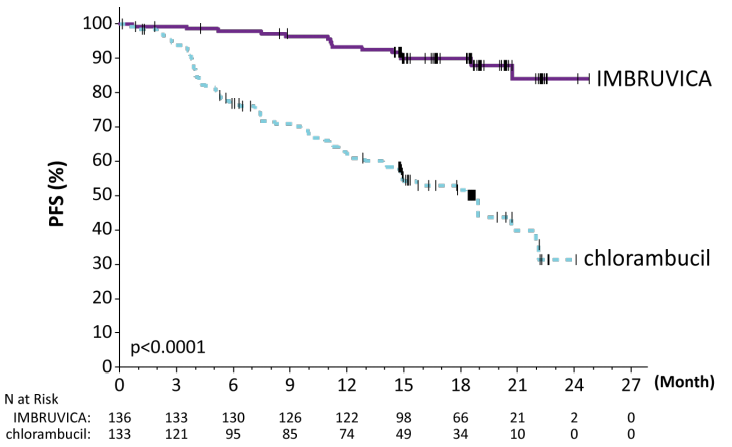
HELIOS研究是一项伊布替尼(亿珂、ibrutinib)联合苯达莫司汀和利妥昔单抗(BR) (NCT01611090)的随机、双盲、安慰剂对照3期研究,在先前接受过CLL或SLL治疗的患者中进行。患者(n = 578)按1:1随机分配,每日服用伊布替尼(亿珂、ibrutinib) 420毫克或安慰剂联合BR,直至疾病进展或出现不可接受的毒性。所有患者均接受BR治疗,最长6个28天周期。在第1周期第2和第3天以及第2-6周期第1和第2天,按70毫克/平方米静脉输注苯达莫司汀30分钟,最多6个周期,所有患者基线时的CLcr ≥ 40毫升/分钟。利妥昔单抗在第一个周期第1天以375毫克/平方米的剂量给药,在第2至6个周期第1天以500毫克/平方米的剂量给药。
中位年龄为64岁(范围:31至86岁),66%为男性,91%为白人。所有患者的基线ECOG表现状态均为0或1。自诊断以来的中位时间为5.9年,既往治疗的中位次数为2次(范围:1至11次治疗)。
基线时,56%的患者至少有一个肿瘤大于5厘米,26%的患者出现伴有11q。
HELIOS研究中的疗效结果见下表,PFS的Kaplan-Meier曲线如下图所示。
表:HELIOS研究中CLL/SLL病患者的疗效结果

a IRC评估;腹腔注射+ BR组24名受试者(8.3%)和安慰剂+ BR组6名受试者(2.1%)获得了完全缓解。
b BR =苯达莫司汀和利妥昔单抗;CI =置信区间;HR =危险比;NE =不可评估。
图:在HELIOS研究中CLL/SLL患者无进展生存期的Kaplan-Meier曲线(ITT人群)
6)iLLUMINATE
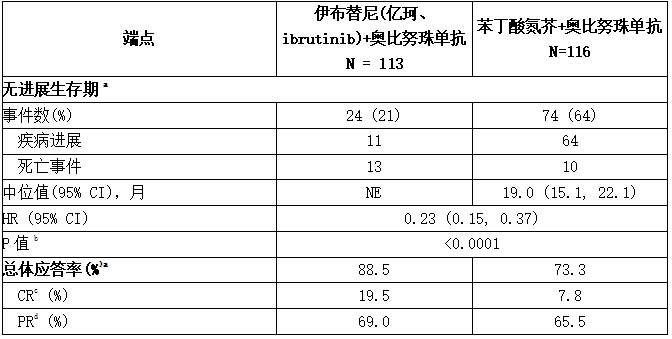
iLLUMINATE研究是一项随机、多中心、3期研究,伊布替尼(亿珂、ibrutinib)联合奥比妥珠单抗与氯丁抗(NCT02264574),在未治疗的CLL或SLL患者中进行。患者年龄为65岁或以上,或年龄小于为65岁,但同时患有其他疾病,通过肌酐清除率小于70毫升/分钟测量的肾功能下降,或存在伴有17p/TP53突变。患者(n = 229)按1:1随机分配,在每个28天周期的第1天和第15天服用伊布替尼(亿珂、ibrutinib) 420毫克(每日一次,直至疾病进展或出现不可接受的毒性)或苯丁酸氮芥(0.5毫克/千克),共6个周期。在两个研究组中,患者在第一个周期的第1、8和15天服用1000毫克奥比努珠单抗,随后在5个后续周期的第一天接受治疗(共6个周期,每个周期28天)。第一剂奥比努珠单抗在第1天(100毫克)和第2天(900毫克)之间分配。
中位年龄为71岁(范围:40至87岁),64%为男性,96%为白人。所有患者的基线ECOG表现状态为0 (48%)或1-2 (52%)。该试验纳入了214名CLL病患者和15名SLL病患者。基线时,65%的CLL/SLL病患者存在高风险因素(伴有17p/TP53突变[18%],伴有11q [15%],或未突变的免疫球蛋白重链可变区(未突变的IGHV) [54%])。开始CLL治疗的最常见原因包括:淋巴结病(38%)、盗汗(34%)、进行性骨髓衰竭(31%)、疲劳(29%)、脾肿大(25%)和进行性淋巴细胞增多(21%)。
研究中位随访时间为31个月,根据IWCLL标准由IRC评估的iLLUMINATE研究中的疗效结果见下表,PFS的Kaplan-Meier曲线见下图。
表:iLLUMINATE研究中对CLL/SLL患者的疗效结果
a 由独立评审委员会评估。
b P值来自非分层对数秩检验。
c 包括1例奥布妥珠单抗组完全缓解且骨髓不完全恢复(CRi)的患者。
d PR = nPR +PR
HR =风险比;NE =不可评估
图:iLLUMINATE研究中CLL/SLL患者无进展生存期的Kaplan-Meier曲线(ITT人群)
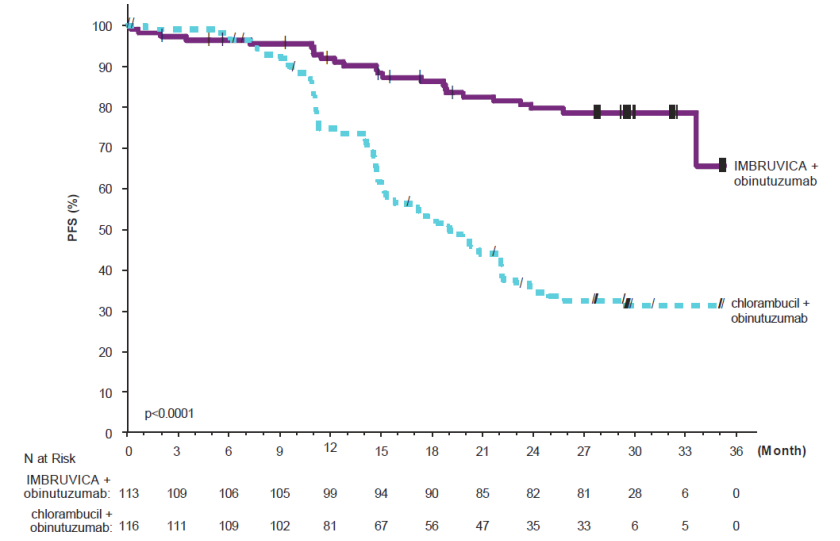
在高危CLL/SLL人群(伴有17p/TP53突变、伴有11q或未突变的IGHV)中,PFS HR为0.15 [95% CI (0.09,0.27)]。
7)E1912
E1912研究是一项伊布替尼(亿珂、ibrutinib)联合利妥昔单抗与标准氟达拉滨、环磷酰胺和利妥昔单抗(FCR)化学免疫疗法(NCT02048813)的随机、多中心、3期研究,研究对象为70岁或以下、既往未接受过治疗、需要系统治疗的CLL或SLL成人患者。基线时,所有患者的CLcr均大于40毫升/分钟。排除了伴有17p缺失的患者。患者(n =529)按2:1的比例随机接受伊布替尼(亿珂、ibrutinib)联合利妥昔单抗或FCR治疗。每日伊布替尼(亿珂、ibrutinib)给药,直至疾病进展或出现不可接受的毒性。氟达拉滨的给药剂量为25毫克/平方米,环磷酰胺的给药剂量为250毫克/平方米,均在第1-6周期的第1、2和3天进行。伊布替尼(亿珂、ibrutinib)利妥昔单抗组在第2周期开始利妥昔单抗治疗,FCR组在第1周期开始利妥昔单抗治疗,在第1个周期第1天以50毫克/平方米给药,第1个周期第2天以325毫克/平方米给药,随后5个周期第1天以500毫克/平方米给药,共6个周期。每个周期为28天。
中位年龄为58岁(范围为28至70岁),67%为男性,90%为白人,98%的ECOG表现状态为0-1。基线时,43%的患者为Rai期或4期,且59%的患者出现高风险因素(TP53突变[6%]、del11q [22%],或未突变的IGHV [53%])。
研究的中位随访时间为37个月,E1912研究中的疗效结果见下表。根据IWCLL标准评估的PFS Kaplan-Meier曲线如下图所示。
表:E1912研究中CLL/SLL患者的疗效结果

a P值来自未分层的对数秩检验。
FCR =氟达拉滨、环磷酰胺和利妥昔单抗;HR =危险比;R =利妥昔单抗;NE =不可评估。
图:E1912研究中CLL/SLL患者无进展生存期的Kaplan-Meier曲线(ITT人群)
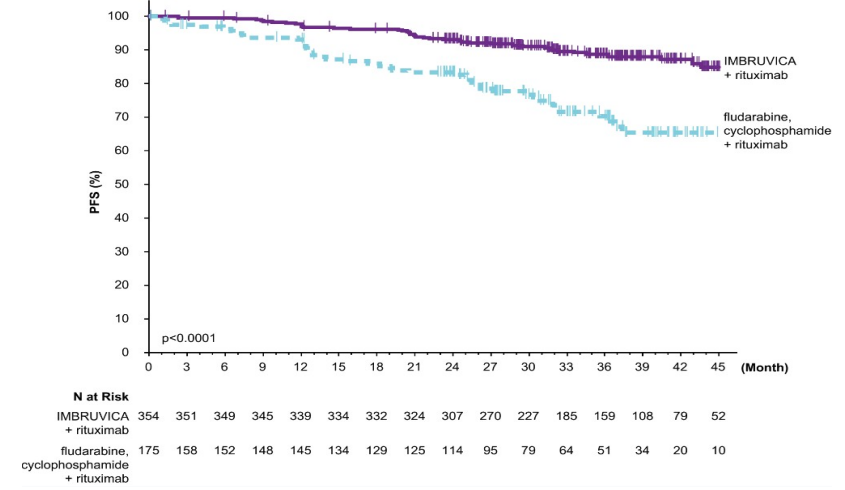
研究的中位随访时间为49个月,未达到中位总生存期,死亡总数为23例:伊布替尼(亿珂、ibrutinib)利妥昔单抗组为11例(3%),FCR治疗组为12例(7%)。
8)淋巴细胞增多
开始伊布替尼(亿珂、ibrutinib)单药剂治疗后,CLL研究中66%的患者出现淋巴细胞计数增加(即自基线增加≥ 50%,且超过绝对淋巴细胞计数5000/mcL)。孤立性淋巴细胞增多症发生在伊布替尼(亿珂、ibrutinib)治疗的第一个月,平均消退14周(范围:0.1至104周)。当伊布替尼(亿珂、ibrutinib)联合给药时,伊布替尼(亿珂、ibrutinib) + BR组淋巴细胞增多为7%,安慰剂+ BR组为6%,伊布替尼(亿珂、ibrutinib) + obinutuzumab组为7%,苯丁酸氮芥+ obinutuzumab组为1%。
2、华氏巨球蛋白血症
伊布替尼(亿珂、ibrutinib)治疗WM患者的安全性和有效性已在两项单臂试验和一项随机对照试验中得到证实。
1)研究1118和INNOVATE单一疗法组
研究1118 (NCT01614821)是一项开放标签、多中心、单臂试验,在63名既往接受过WM治疗的患者中进行。伊布替尼(亿珂、ibrutinib)口服给药,每日一次,每次420毫克,直至疾病进展或出现不可接受的毒性。由研究者和IRC根据华氏巨球蛋白血症国际研讨会采用的标准评估应答。
中位年龄为63岁(范围:44至86岁),76%为男性,95%为白人。所有患者的基线ECOG表现状态均为0或1。自诊断以来的中位时间为74个月,先前治疗的中位次数为2次(范围为1至11次治疗)。基线时,血清IgM中位值为3.5克/分升(范围:0.7至8.4克/分升)。
根据IRC定义为部分响应或更好的响应如所示下表。
表:根据研究1118中WM患者的IRC评估得出的应答率和应答持续时间(DOR)
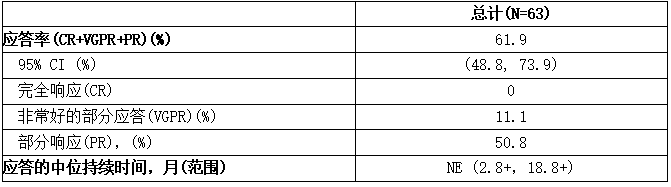
CI =置信区间;NE =不可评估。
中位反应时间为1.2个月(范围:0.7-13.4个月)。
INNOVATE研究中单药治疗组包括31例既往接受过WM治疗、但既往接受含利妥昔单抗治疗失败并接受过单药剂伊布替尼(亿珂、ibrutinib)治疗的患者。中位年龄为67岁(范围:47至90岁)。81%的患者基线ECOG表现状态为0或1,19%的患者基线ECOG表现状态为2。既往治疗的中位次数为4次(范围:1至7次治疗)。总体随访61个月,每次IRC评估在INNOVATE单药治疗组中观察到的应答率为77% (0% CR,29% VGPR,48% PR)。中位反应时间为33个月(范围:2.4至60.2+个月)。
2)INNOVATE
INNOVATE研究是一项随机、双盲、安慰剂对照的伊布替尼(亿珂、ibrutinib)或安慰剂联合利妥昔单抗(NCT02165397)的3期研究,在治疗初期或之前接受过WM治疗的患者中进行。患者(n = 150)按1:1随机分配,每日服用伊布替尼(亿珂、ibrutinib) 420毫克或安慰剂联合利妥昔单抗,直至疾病进展或出现不可接受的毒性。利妥昔单抗每周给药,剂量为375 毫克/平方米,连续4周(第1-4周),随后每周利妥昔单抗第二疗程,连续4周(第17-20周)。主要疗效结果衡量指标是由IRC评估的无进展生存期(PFS),以及对应答率的额外疗效衡量指标。
中位年龄为69岁(范围为36至89岁),66%为男性,79%为白人。93%的患者的基线ECOG表现状态为0或1,7%的患者的基线ECOG表现状态为2。45%的患者未接受治疗,55%的患者以前接受过治疗。在既往治疗的患者中,既往治疗的中位数为2次(范围,1至6次治疗)。基线时,血清IgM中位值为3.2克/分升(范围为0.6-8.3克/分升),77%的患者中存在MYD88 L265P突变,13%的患者中没有突变,9%的患者无法评估突变状态。
一项探索性分析表明,65%的伊布替尼(亿珂、ibrutinib) + R组患者和39%的安慰剂 + R 组患者的血红蛋白得到了持续改善(定义为在不输血或不使用生长因子的情况下,血红蛋白比基线上升大于等于2克/分升,持续时间至少 8 周)。
经过63个月的总体随访,IRC在最终分析创新时评估的疗效结果如下表所示,PFS的Kaplan-Meier曲线如下图所示。
表:INNOVATE中IRC研究中对WM患者的疗效结果(最终分析)
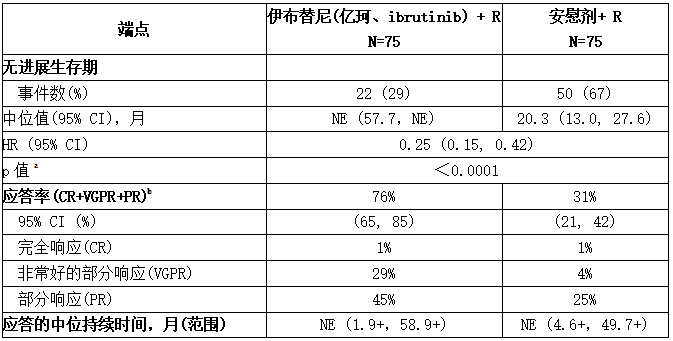
CI =置信区间;HR =危险比;NE =不可评估;R =利妥昔单抗。
a P值来自分层对数秩检验。
b 与应答率相关的P值<0.0001。
图:INNOVATE研究中WM患者无进展生存期的Kaplan-Meier曲线(ITT人群)
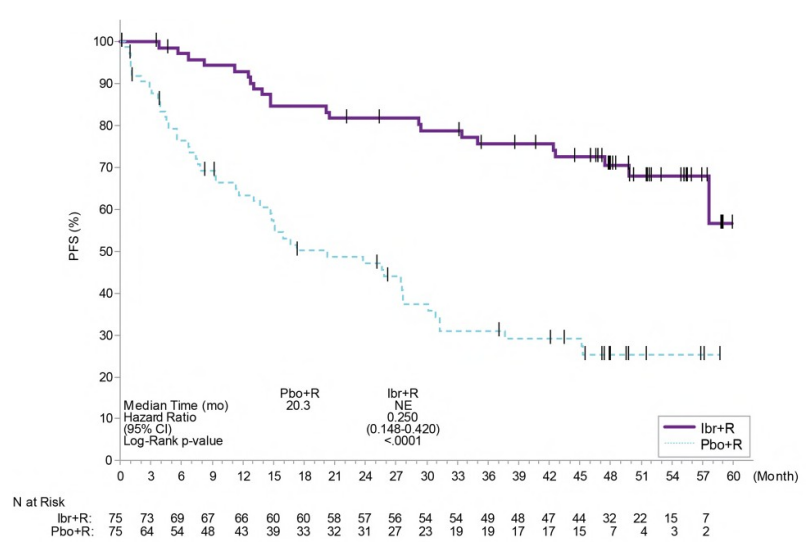
两个治疗组均未达到中位总生存期。在63个月的总体随访中,使用伊布替尼(亿珂、ibrutinib) + R的9名(12%)患者和使用安慰剂+ R的10名(13.3%)患者死亡。随机分配到安慰剂+ R组的患者中有47%交叉接受伊布替尼(亿珂、ibrutinib)治疗。
3、慢性移植物抗宿主病
1)研究1129
伊布替尼(亿珂、ibrutinib)治疗cGVHD的安全性和疗效在研究1129 (NCT02195869)中进行了评估,这是一项针对42例一线皮质类固醇治疗失败且需要额外治疗的cGVHD患者的开放标签、多中心、单臂试验。伊布替尼(亿珂、ibrutinib)口服给药,剂量为420毫克,每日一次。研究者使用2005年美国国立卫生研究院(NIH)共识小组反应标准评估了这些反应,并对标准进行了两次修改,以与更新的2014年NIH共识小组反应标准保持一致。
中位年龄为56岁(范围为19至74岁),52%为男性,93%为白人。导致移植的最常见潜在恶性肿瘤是急性淋巴细胞白血病、急性髓性白血病和CLL病。自cGVHD诊断以来的中位时间为14个月时,既往cGVHD治疗的中位次数为2次(范围为1至3次治疗),60%的患者Karnofsky评分≤ 80。大多数患者(88 %)在基线时至少有2个器官受累,其中最常见的参与的器官为口(86%)、皮肤(81%)和胃肠道(33%)。基线时的皮质类固醇日中位剂量(泼尼松或泼尼松等效物)为0.3毫克/千克/天,52%的患者在基线时接受全身性皮质类固醇以外的持续免疫抑制剂治疗。
感染预防按照机构指南进行管理,79%的患者接受磺胺类药物和甲氧苄啶联合治疗,64%接受三唑衍生物治疗。
疗效结果见下表。
表:研究1129中cGVHD患者的最佳总体缓解率(ORR)和基于研究者评估的持续缓解率a
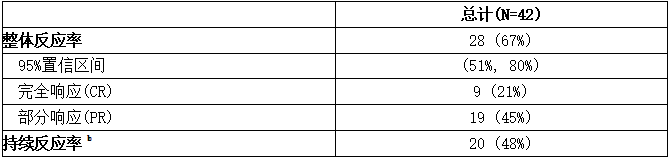
CI =置信区间。
a基于2005年NIH反应标准的研究者评估进行了两个修改(对非cgvhd异常的器官添加“不可评估”,器官评分从0到1的变化不被认为是疾病进展)。
b持续缓解率定义为达到CR或PR持续至少20周的患者的比例。
与首次计划应答评估一致的中位应答时间为12.3周(范围:4.1 ~ 42.1周)。在涉及cGVHD的所有器官(皮肤、口腔、胃肠道和肝脏)中均观察到应答。
ORR结果得到患者报告的症状困扰探索性分析的支持,该分析显示,在至少连续2次就诊的24% (10/42)患者中,Lee症状量表总体汇总评分至少下降7分。
2)iMAGINE
在iMAGINE(NCT03790332)中评估了免疫的安全性和有效性,这是一项开放标签、多中心、单臂试验,用于治疗NIH共识标准定义的1岁至22岁以下中重度的儿童和年轻成人cGVHD患者。该研究包括47例在之前一个或多个系统治疗失败后需要额外治疗的患者。所有患者的血小板≥值为30 x 10 9 /升;绝对中性粒细胞计数≥值为1.0 x 10 9 /升;AST或ALT≤为3x ULN;总胆红素值为≤为1.5 x ULN;估计肌酐清除率≥为30毫升/分钟。如果单器官泌尿生殖系统受累是cGVHD的唯一表现,则排除患者。
12岁及以上患者口服伊布替尼(亿珂、ibrutinib)420毫克,每日1次,1岁至12岁以下患者口服恩布鲁克240毫克/平方米,每日1次。允许对cGVHD同时进行支持性护理治疗。不允许在研究期间开始新的全身性cGVHD治疗。
中位年龄为13岁(范围为1至19岁)。在47例患者中,70%的患者为男性,36%为白人,9%为黑人或非裔美国人,55%为其他或未报告。cGVHD诊断的中位时间为16.1个月,既往cGVHD治疗的中位数为2次(范围1~12)。大多数患者(87%)在基线时至少有2个器官受累,49%的患者在基线时有肺受累;26%的患者的卡诺夫斯基/兰斯基表现评分为小于80。基线时每日皮质类固醇中位剂量(泼尼松或泼尼松当量)为0.47毫克/千克/天,61%(31例中的19例)患者在基线时除了接受全身皮质类固醇外,还接受了持续的免疫抑制剂。根据机构指南对感染的预防进行了管理,72%的患者接受磺胺类药物和甲氧苄啶的联合治疗,70%的患者接受全身抗真菌药物治疗。
免疫的疗效是根据第25周的总应答率(ORR)确定的,根据2014年国家卫生研究院(NIH)共识发展项目应答标准,总应答包括完全应答或部分应答。疗效结果见下表。
表:对既往使用iMAGINE治疗的cGVHD患者的疗效结果a
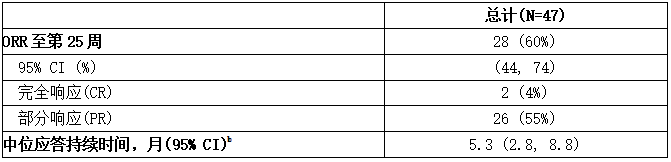
CI =置信区间;ORR =总体应答率。
a根据2014年NIH共识开发项目响应标准进行的评估。
b基于研究中的所有应答者,从对cGVHD进展、死亡或新系统治疗的首次应答开始计算。
首次缓解的中位时间为0.9个月(范围:0.9至6.1个月)。cGVHD首次出现死亡反应或接受新全身治疗的中位时间为14.8个月(95% CI: 4.6,不可评估)。
ORR结果得到患者报告的症状困扰探索性分析的支持,该分析显示,50% (13/26)的12岁及以上患者在第25周期间的Lee症状量表总体汇总评分至少下降7个百分点。



互联网药品信息服务资格证书

孟加拉耀品国际授权书

孟加拉珠峰制药授权书

孟加拉伊思达制药授权书

孟加拉伊思达制药授权书

土耳其医院授权书
 正品保障
正品保障
 厂家直采
厂家直采
 专业药师
专业药师
 品类齐全
品类齐全