即使在符合条件的肌肉浸润性尿路上皮癌患者中采用新辅助治疗——顺铂为基础的化疗,然后进行根治性手术,但术后仍具有较高的复发率,且没有辅助治疗的1级证据(自至少一个设计良好的随机对照临床试验中获得的证据)。我们旨在评价阿替利珠单抗(atezolizumab )作为辅助治疗在肌肉浸润性尿路上皮癌患者中的治疗效果。
研究方法
IMvigor 010研究是在24个国家或地区进行的一项多中心、开放标签、随机、3期试验,在根治性膀胱切除术或肾尿管切除术并伴有淋巴结切除术后的14周内,入组了18岁及以上、组织学证实为肌肉浸润性尿路癌、东部合作肿瘤学组表现状态为0、1或2的患者。
入组病理分期:1)如果患者进行过新辅助化疗,则为ypT2-4a或ypN+; 2)如果患者未进行新辅助化疗,则为pT3-4a或pN+。不允许术后放疗或辅助化疗;如果没有给予新辅助化疗,患者出组或不进行顺铂为基础的辅助化疗。将患者按1:1的比例随机分配,接受1200mg阿替利珠单抗,每3周静脉注射一次,持续16个周期或长达1年。按以往是否使用新辅助化疗、切除的淋巴结数目、病理结节状态、肿瘤阶段和肿瘤浸润免疫细胞的PD-L1表达状态进行分层。主要终点是意向治疗人群的无病生存期(DFS)。
研究结果
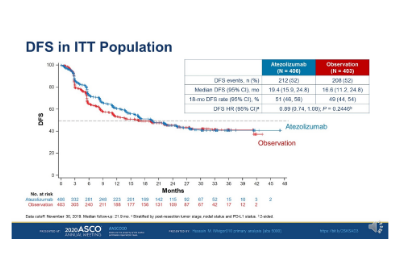
在2015年10月5日至2018年7月30日期间,纳入了809名患者,其中406人被分配到阿替利珠单抗组,403人被分配到观察组。中位随访时间为21.9个月。阿替利珠单抗的中位无病生存期为19.4个月,观察组为16.6个月。
最常见的3级或4级不良事件是尿路感染、肾盂肾炎和贫血。122名(31%)接受阿替利珠单抗的患者和71名(18%)接受观察的患者发生了严重不良事件。63名(16%)接受atezolizumab的患者发生了治疗相关的3或4级不良事件。阿替利珠单抗组发生了1例治疗相关的死亡,原因是急性呼吸窘迫综合征。
结论
IMvigor010是规模最大、首个旨在评估检查点抑制剂在肌肉浸润性尿道癌中作用的3期辅助研究。该试验没有达到主要终点,即阿替利珠单抗组的无病生存期较观察组并无改善。
阿替利珠单抗总体上是可以耐受的,没有新的安全信号;但与转移性尿路癌研究相比,导致停药的不良事件报告频率更高。
参考资料:Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。

.png)