



《柳叶刀肿瘤学》上报道的单中心II期试验显示,在曲妥珠单抗(trastuzumab,赫赛汀)联合化疗的基础上,加入帕博利珠单抗(pembrolizumab,Keytruda, 派姆单抗,可瑞达),对HER2阳性转移性食管和胃癌的一线治疗具有积极作用。
试验细节
2016年11月至2019年1月,研究人员在纪念斯隆凯特琳癌症中心招募了37名可评估的胃癌、食管癌或胃食管交界处癌患者。患者有资格接受200mg帕博利珠单抗的初始诱导周期和8mg/kg曲妥珠单抗的负荷剂量。在随后的周期中,患者在第1天接受130 mg/m²的奥沙利铂或80 mg/m²的顺铂,850 mg/m²的卡培他滨每天两次,持续2周,然后停药1周(或在第1-5天每天服用800 mg/m²的氟尿嘧啶),在每个3星期周期的第1天,服用200 mg的帕博利珠单抗和6 mg/kg的曲妥珠单抗。
主要终点是6个月无进展生存期。如果37名患者中有26名或更多在6个月时没有发生疾病进展,则认为该方案可接受,可进行进一步研究。
关键发现
总体而言,38%的患者的程序性细胞死亡配体1(PD-L1)表达≥1%,其他所有患者均为PD-L1阴性肿瘤或状态不明。大多数患者接受的化疗方案包括卡培他滨(65%)和奥沙利铂(97%)。
数据截止时(2019年8月),幸存者的中位随访时间为13.0个月。达到主要终点,37例患者中,26例(70%,95%可信区间[CI]=54%-83%)在6个月时仍无疾病进展。中位无进展生存期为13.0个月(95%CI=8.6个月-未达到)。
Kaplan-Meier估计的中位总生存期为27.3个月(95%CI=18.8个月-未达到),12个月总生存率为80%。在35例可测疾病患者中,32例(91%)观察到客观缓解(包括6例[17%]完全缓解),3例(9%)病情稳定,疾病控制率达100%。
不良事件
最常见的任何级别治疗相关不良事件是神经病变(97%)。最常见的治疗相关3级或4级不良事件是淋巴细胞减少症(24%)、电解质减少(16%)和贫血(11%)。两名患者发生了与治疗相关的3级或4级严重不良事件(3级肾炎,导致两人停止治疗)。总的来说,10%的患者因治疗相关不良事件而停止治疗。免疫相关不良事件包括间质性肾炎(8%)、转氨酶升高(5%)和结肠炎(3%),4名患者(11%)需要停药帕博利珠单抗。未出现与治疗相关的死亡。
结论
研究人员总结道,“帕博利珠单抗可以安全地与曲妥珠单抗和化疗联合使用,对HER2阳性转移性食管胃癌有良好的治疗作用。目前正在进行一项随机III期临床试验,评估帕博利珠单抗对比安慰剂联合曲妥珠单抗和化疗一线治疗HER2阳性转移性食管胃癌的疗效和安全性(KEYNOTE-811)。”
临床招募
目前,该试验——比较Pembrolizumab联合曲妥珠单抗和化疗与安慰剂联合曲妥珠单抗和化疗在HER2阳性晚期胃或胃食管结合部腺癌患者中的III期试验,正在进行临床招募,具体信息如下:
试验目的:
多中心、随机、双盲III期研究以确定帕博利珠单抗联合曲妥珠单抗和化疗,相比曲妥珠单抗和化疗,用于治疗HER2阳性胃癌受试者的疗效和安全性
试验设计:
试验分类:安全性和有效性 试验分期:3期 设计类型:平行分组 随机化:随机化 盲法:双盲 试验范围:国际多中心试验
入选标准:
1.经组织学或细胞学证实诊断为既往未曾治疗的局部晚期不可切除的或转移性HER2阳性胃或GEJ腺癌、在签署知情同意书当天年满18岁的男性/女性受试者。 2.HER2阳性,定义为中心实验室对原发性或转移性肿瘤病灶评估的IHC3+或IHC2+伴ISH(或FISH)+。ISH阳性定义为HER2基因拷贝数与CEP17信号数量的比值≥2.0。如果比值<2.0但HER2基因拷贝数>6,则可以认为受试者为ISH阳性。 3.具有可测量疾病,定义根据RECIST 1.1,由中心研究者确定。位于既往放疗区域的肿瘤病变如果已经出现疾病进展,则认为是可测量的病灶。注:整个研究期间,应使用完全相同的影像采集和处理参数。 4.男性受试者: 男性受试者必须同意在研究期间直至所有研究治疗最后一次给药后7个月内使用如方案附录3所述的适当的避孕方法。 5.女性受试者: 女性受试者如果没有妊娠(见方案附录3)、非母乳喂养,并且满足以下至少一个条件,则有资格参与研究: a.)并非方案附录3定义的育龄妇女(WOCBP) 或 b.)同意在研究期间直至研究治疗最后一次给药后7个月内遵守方案附录3中的WOCBP的避孕指导。 6.受试者(或法律上可接受的代表,如适用)提供试验的书面知情同意书。受试者还可能会提供对未来生物医学研究的同意意见。但是受试者可以参加主要试验,但不参加未来的生物医学研究。
排除标准:
1.既往针对局部晚期无法切除的或转移性胃癌/GEJ癌接受治疗。受试者既往可以接受新辅助治疗或辅助治疗,只要治疗在随机化前至少6个月时结束且没有进展 2.在随机前28天内接受过大手术、开放性活检或重大创伤性损伤,或预期在研究治疗期间接受大手术。注:如果受试者曾接受过大手术,则在开始研究性治疗之前,必须已从既往干预导致的毒性和/或并发症中完全恢复。 3.随机化前的14天内曾接受放疗。受试者必须已经从所有放疗相关毒性中恢复,无需使用激素,没有放射性肺炎。非CNS疾病的姑息性放疗(≤2 周的放疗)允许有1周的洗脱期。 4.已知在过去5年内患有正在发展或需要积极治疗的其它恶性肿瘤。除皮肤基底细胞癌、已经接受潜在治愈性治疗的皮肤鳞状细胞癌或原位宫颈癌外。 5.具有已知的活动期CNS转移和/或癌性脑膜炎。既往接受过脑转移治疗的受试者,如果他们影像学稳定(即通过重复影像学检查确认至少4周没有发生进展)(注意,在研究筛选期间应进行重复检查)、临床稳定并且在第一次研究治疗之前至少14天不需要类固醇治疗,则可以参与研究。 6.在过去的2年内患有需要全身性治疗(即,疾病治疗药物、皮质激素类药物或免疫抑制性药物)的活动期自身免疫性疾病。替代疗法(例如甲状腺素、胰岛素或者用于肾上腺或垂体机能不全的生理性皮质类固醇替代疗法等)不被视为全身性治疗,是允许的。 (注:以上为部分标准,最终入选由研究人员确定)
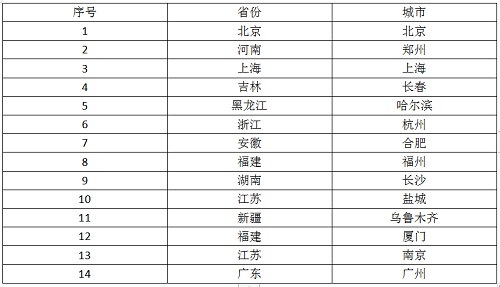
主要研究中心所在地(具体启动情况以后期咨询为准)
如果想了解更多信息,可联系医伴旅团队,我们将为您解惑。联系电话:400-001-2811
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
