



关于Margetuximab
Margetuximab是一种靶向人类表皮生长因子受体2(HER2癌蛋白)的研究性免疫增强单克隆抗体。HER2在乳腺、胃食管和其他实体瘤的肿瘤细胞中表达。Margetuximab旨在提供HER2阻断,并更好地增强免疫系统的参与。

SOPHIA临床试验
SOPHIA临床试验在北美、欧洲和亚洲的200个试验点招募了536名患有HER2+转移性乳腺癌的女性患者。患者接受margetuximab或曲妥珠单抗(trastuzumab,Herceptin,赫赛汀)联合化疗药物(卡培他滨、艾日布林、吉西他滨、长春瑞滨,四种之一)的治疗,并进行直接比较。所有的试验患者之前都接受过曲妥珠单抗和帕妥珠单抗(pertuzumab,Perueta)治疗,大约90%的患者之前接受过ado-trastuzumab emtansine治疗。
与曲妥珠单抗联合化疗相比,接受margetuximab联合化疗的患者在无癌生存期内的风险降低了24%。
2019年圣安东尼奥乳腺癌研讨会上更新了试验结果,margetuximab联合化疗组患者的平均无癌症进展生存期为5.8个月,而曲妥珠单抗联合化疗组为4.9个月,对比之下,margetuximab延长了PFS。在CD16A基因型患者中,margetuximab延缓癌症进展的效果似乎更好。
试验中约85%的患者携带CD16A(FcγRIIIa)158F等位基因,这是一种生物标记物,与曲妥珠单抗和其他抗体的临床反应减弱有关。与曲妥珠单抗相比,margetuximab将这些患者的风险降低了32%。
Margetuximab联合化疗可与曲妥珠单抗联合化疗相媲美,将成为HER2+晚期乳腺癌患者的另一种治疗选择。
临床招募
目前,一项评估margetuximab的临床试验——评价在既往抗HER2治疗进展的中国HER2阳性晚期转移性乳腺癌患者中margetuximab联合化疗对比曲妥珠单抗联合化疗的有效性和安全性,正在进行临床招募,具体信息如下:
试验目的:
评价在既往抗HER2治疗进展的中国HER2阳性晚期转移性乳腺癌患者中margetuximab联合化疗对比曲妥珠单抗联合化疗的有效性和安全性。
试验设计:
试验分类:安全性和有效性 试验分期:2期 设计类型:平行分组 随机化:随机化 盲法:开放 试验范围:国内试验
入选标准:
1.签署书面知情同意书 2.年龄 ≥18岁 3.患者 ECOG身体状态评分为 0或 1 4.组织学确诊的HER2 表达阳性的转移乳腺癌患者。 5.在转移性疾病阶段既往接受过 ≥2线抗 HER2靶向治疗 (需包含曲妥珠单抗,其他 抗 HER2靶向治疗 如拉帕替尼、吡咯妥珠 如拉帕替尼、吡咯妥珠 如拉帕替尼、吡咯妥珠 如拉帕替尼、吡咯妥珠 单抗、 T-DM1等) ;不论患者在新辅助 /辅助阶段是否接受过抗 HER2 6.在转移性疾病阶段既往抗肿瘤治疗需≤3线(包括抗HER2靶向治疗或化疗),在最后一线治疗过程中或治疗结束后出现RECIST 1.1标准评估的疾病进展
排除标准:
1.有症状的、及未能够控制的脑转移或软脑膜转移。患者如果有已知并治疗过的脑转移,必须有随机前 4 周内的基线 CT 或 MRI 资料,随机前接受过至少 4 周的脑转移治疗;如果需要在随机后使用类固醇激素,需要在随机前类固醇激素已稳定使用(≤10 mg/天强的松或等效)至少 4 周,并没有相关的神经症状 2.存在无法通过引流或其他方法控制的第三间隙积液(如大量胸水和腹水) 3.随机前 2 周内接受过局部或全身抗肿瘤治疗,包括放疗、化疗、手术治疗(指治疗乳腺癌的大型手术)或分子靶向治疗者;随机前 7 天内接受过抗肿瘤内分泌治疗者 4.随机前 4 周内接受过任何研究性药物治疗(包括 margetuximab) 5.随机前 4 周内有重大手术史,且手术后有尚未恢复的手术效应 6.既往在随机前 5 年内患有其他恶性肿瘤,不包括已根治的宫颈原位癌、皮肤基底细胞癌或皮肤鳞状细胞癌 (注:以上为部分标准,最终入选由研究人员确定)
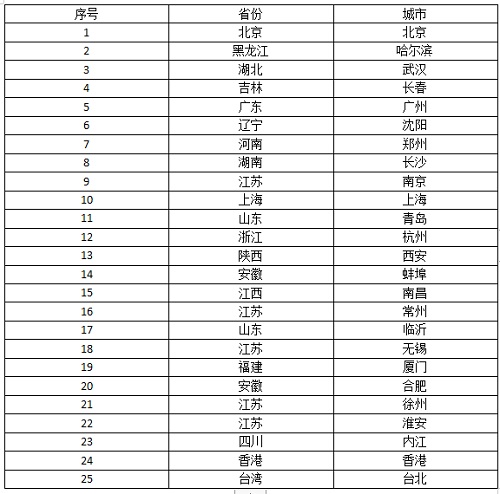
主要研究中心所在地(具体启动情况以后期咨询为准)
如果想了解更多信息,可联系医伴旅团队,我们将为您解惑。联系电话:400-001-2811
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
