



发表在《临床肿瘤学杂志》上的2期HORIZON试验的结果显示,melflufen联合地塞米松(dexamethasone,Ozurdex)对重度预处理复发或难治性多发性骨髓瘤患者(包括三级难治性和髓外疾病患者)具有有临床意义的疗效和可控的安全性。
概述
重要的是,该2期数据是正在向FDA申请新药优先审评资格的基础,申请FDA加快批准melflufen联合地塞米松用于治疗三级难治性多发性骨髓瘤患者,这些患者至少对一种蛋白酶体抑制剂、一种免疫调节药物和一种抗CD38单克隆抗体耐药。
Oncopeptides AB公司首席医疗官Klaas Bakker博士说:“HORIZON试验的结果表明,melflufen联合地塞米松有可能为难治性和预后差的患者提供一个治疗选择,包括三级难治性骨髓瘤患者和髓外疾病患者。这些患者治疗选择有限,或者根本没有选择。引入新的治疗方法至关重要。”
试验设计
该关键、单臂、多中心试验招募了复发性或难治性多发性骨髓瘤患者,年龄75岁以上,对泊马度胺(pomalidomide,Pomalyst)和/或抗CD38单克隆抗体耐药,在每个28天周期的第1天静脉注射melflufen 40mg,每周口服一次地塞米松40mg或20mg。
试验的主要终点是总缓解率(ORR),定义为部分缓解或更好,由研究人员评估,并由独立评审确认。次要终点包括缓解持续时间、无进展生存期(PFS)、总生存期(OS)和安全性。初步分析已完成,尽管长期随访仍在进行。
157名患者被招募进入试验并接受治疗,其中119名患者(76%)患有三级难治性疾病,55名(35%)患有髓外疾病,92名(59%)对先前的烷基化药物治疗耐药。
试验结果和安全性
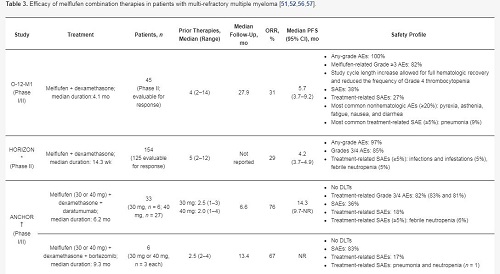
在所有接受治疗的人群中,ORR为29%;在三级难治人群中,ORR为26%。中位随访14个月,在所有接受治疗的人群中,中位缓解持续时间为5.5个月,中位PFS为4.2个月,中位OS为11.6个月。
关于安全性,96%的患者发生了3级或以上治疗相关不良事件(AE)。最常见的3级或以上AE为中性粒细胞减少(79%)、血小板减少(76%)和贫血(43%)。最常见的3级或4级非血液学事件为肺炎(10%)。4例患者同时出现血小板减少和出血(均为3/4级,但完全可逆)。97名患者(62%)出现胃肠道事件,主要为1级或2级(93%),无一例为4级。
总结
“这些发现基本建立在先前报道的结果的基础上,但试验人群更符合当前的治疗实践,其疾病为复发性、难治性和高度耐药(如,对抗CD38单克隆抗体和/或泊马度胺耐药,以及对先前的来那度胺、地塞米松和蛋白酶体抑制剂耐药)。”研究作者写道。
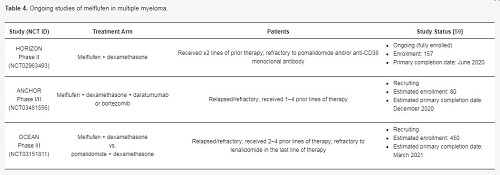
基于当前试验的结果,多中心、随机、全球、3期OCEAN试验(OP-103; NCT03151811)正在进一步评估melflufen+地塞米松vs泊马度胺+地塞米松对早期复发患者的疗效和安全性。此外,研究melflufen+地塞米松联合硼替佐米(bortezomib,Velcade)或达雷木单抗(daratumumab,Darzalex)的试验也在进行中,迄今已报告了良好结果。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
