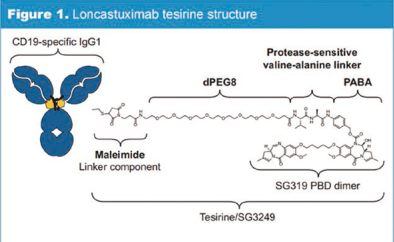
最近,美国食品和药物管理局(FDA)发布了关于治疗弥漫性大B细胞淋巴瘤(DLBCL)、小细胞肺癌(SCLC)、急性髓系白血病(AML)、胆道癌和移植物抗宿主病的药物管制决定。 Loncastuximab Tesirine治疗复发性或难治性DLBCL的优先审查 FDA接受了loncastuximab tesirine治疗复发性或难治性DLBCL的生物制剂许可证申请,并授予优先审查。美国食品和药物管理局将《处方药使用者费用法案》(PDUFA)的目标日期定在2021年5月21日。 Loncastuximab tesirine(原名ADCT-402)是一种抗体药物偶联物,由一种抗人CD19的人源化单克隆抗体组成,并通过连接物与pyrrolobenzodiazepine (PBD,吡咯并苯并二氮杂卓) 二聚体细胞毒素偶联。一旦与表达CD19的细胞结合,Loncastuximab tesirine可被细胞内化,随后释放细胞毒素。该毒素能不可逆地与DNA结合,从而产生阻止DNA链分离的强力链间交联,从而破坏复制等必要的DNA代谢过程,最终导致细胞死亡。CD19是一个经验证的治疗B细胞恶性肿瘤的热门靶点。
LOTIS 2是一项2期多中心、开放标签、单臂临床试验,评估了loncastuximab tesirine治疗复发性或难治性DLBCL患者的疗效和安全性。 loncastuximab tesirine的总缓解率为48.3%,完全缓解率为24.1%。耐受性是可控的,在≥10%的患者中,最常见的≥3级治疗紧急不良事件为中性粒细胞减少、血小板减少、γ-谷氨酰转移酶升高和贫血。 Loncastuximab tesirine也在LOTIS 3(联合伊布替尼治疗复发性或难治性DLBCL或套细胞淋巴瘤的 I/II期临床试验)和LOTIS 5(联合利妥昔单抗治疗复发性或难治性DLBCL的III期临床试验)试验中进行评估。 伊立替康脂质体注射液作为SCLC的二线单药疗法的快速通道指定 FDA批准了伊立替康脂质体注射液用于治疗SCLC的快速通道指定(这些患者在一线铂类药物治疗后病情进展)。该药剂是拓扑异构酶1抑制剂。

目前,美国和欧洲已批准该注射液与氟尿嘧啶和亚叶酸联合应用于吉西他滨治疗后病情进展的胰腺转移性腺癌患者。 一项正在进行的3期随机试验(RESILIENT),以评估研究性伊立替康脂质体注射液作为单药治疗SCLC患者的有效性和安全性,这些患者在一线铂类方案治疗后出现疾病进展。 Eprenetapopt治疗TP53突变型AML的快速通道指定 FDA授予eprenetapopt治疗TP53突变型AML的快速通道指定。之前eprenetapopt获得了突破性疗法、孤儿药称号和快速通道指定,用于治疗TP53突变型骨髓增生异常综合征(MDS)。 Eprenetapopt(APR-246)是一种小分子药物,可通过恢复野生型p53构象和功能来再度活化突变的和失活的p53蛋白,从而诱导人类癌细胞的程序性细胞死亡;其对多种实体瘤和血液系统癌症(包括MDS,AML和卵巢癌等)有临床前的抗肿瘤活性。此外,Eprenetapopt与传统的抗癌药物(如化疗),以及新型机制型抗癌药物和免疫肿瘤检查点抑制剂的联合,均有强大的协同作用。 除了临床前试验,eprenetapopt的I/II期临床项目已经完成,证明了其良好的安全性,以及在血液系统恶性肿瘤和TP53基因突变的实体瘤中的生物学和临床活性。 Zanidatamab治疗胆道癌的突破性治疗指定 FDA授予zanidatamab突破性治疗的称号,用于先前治疗过的HER2基因扩增的胆道癌患者。 Zanidatamab是一种双特异性抗体,可以同时结合HER2两个非重叠表位(双互补位结合)。这种独特的设计可产生多种作用机制,包括双重HER2信号阻断、增加的结合、从细胞表面去除HER2蛋白和导致抗肿瘤活性的强效应器功能。
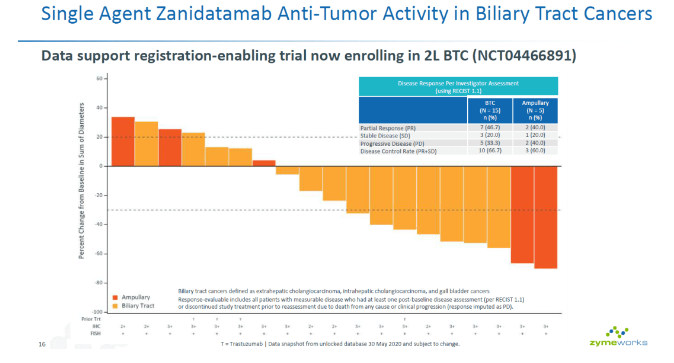
Zanidatamab正在全球进行多个阶段的I期、II期和支持注册的临床试验中开发,作为表达HER2的实体肿瘤患者的靶向治疗选择。 今年早些时候,启动了一项全球IIb期注册研究,该研究使Zanidatamab单药治疗先前接受过治疗的HER2基因扩增的胆道癌患者成为可能。 Belumosudil在慢性移植物抗宿主病患者中的新药应用 FDA接受了belumosudil (KD025)的新药申请,用于治疗慢性移植物抗宿主病。FDA批准了对该申请的优先审查,为期6个月,并指定PDUFA的目标行动日期为2021年5月30日。 FDA先前授予belumosudil 突破性治疗指定,用于治疗两种或两种以上系统疗法失败后的慢性移植物抗宿主病。FDA先前还授予belumosudil 孤儿药称号,用于治疗慢性移植物抗宿主病。 belumosudil 是一种选择性口服ROCK2抑制剂,ROCK2是一种调节炎症反应和促纤维化过程的信号通路。ROCKstar (KD025-213)是一项重要的临床试验,评估了belumosudil 治疗接受过两种或两种以上系统疗法的慢性移植物抗宿主病的疗效。
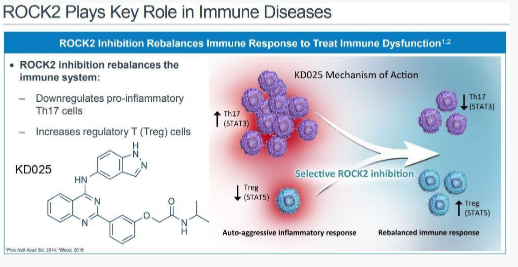
ROCKstar (KD025-213)是一项正在进行的开放标签试验,用于治疗慢性移植物抗宿主病患者,这些患者至少接受过两种系统治疗。患者被随机分配接受200毫克,每天1次或200毫克,每天2次的belumosudil ,每组66例患者。 入组2个月后进行的中期分析满足了总缓解率的主要终点。在研究完成6个月后进行的初步分析中,belumosudil在各研究组的总缓解率分别为73%和74%。belumosudil 耐受性良好,不良事件与患者人群的预期一致。 Infiglatinib在胆管癌中的新药应用 FDA接受了infigratinib的新药申请,infigratinib是一种口服FGFR1-3选择性抑制剂,用于治疗胆管癌。该申请已被授予优先审查指定。 Infigratinib是一种口服的、ATP竞争性FGFR1-3酪氨酸激酶抑制剂,用于治疗FGFR驱动的疾病患者,包括胆管癌和尿路上皮癌。 FDA批准用于治疗四肢骨样骨瘤的设备 11月27日,FDA批准了Sonalleve MR-HIFU系统用于治疗四肢骨样骨瘤。磁共振引导的高强度聚焦超声(MR-HIFU)治疗是一种图像引导技术,将高强度聚焦超声消融与实时监测超声过程中的温度变化相结合。

注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。