



2021年1月4日, Provention Bio公司宣布,已经向美国食品和药物管理局(FDA)提交了用于延迟或预防高危人群临床1型糖尿病(T1D)的泰普利珠单抗(teplizumab)的生物制品许可申请(BLA)。FDA还批准了Provention的优先审查请求。
teplizumab的BLA,基于TrialNet开展的“At-Risk”研究的临床数据。该研究评估了teplizumab用于高危群体预防或延缓发生临床1型糖尿病(T1D)的疗效和安全性。研究数据已于2019年6月在旧金山举行的美国糖尿病协会(ADA2019)第79届科学会议上公布。
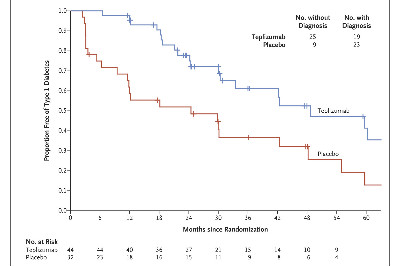
结果显示,与安慰剂相比,单个为期2周(14天)疗程的teplizumab治疗显著推迟了高危儿童和成人临床T1D的发病和诊断时间,T1D发病率降低50%,发病中位时间推迟至少2年:特普利珠单抗组诊断的中位时间为48.4个月,安慰剂组为24.4个月(危险比,0.41;95%置信区间[CI],0.22~0.78;双面P=0.006)。
当调整了年龄、随机化前第二次口服葡萄糖耐量试验结果或存在抗GAD65抗体等预设协变量后,危险比仍然显著。
关于1型糖尿病
1型糖尿病是一种慢性自身免疫性疾病,导致产生胰岛素的β细胞破坏,并依赖外源胰岛素生存。一些干预措施推迟了1型糖尿病患者胰岛素生产的损失,但可能需要在诊断前影响临床进展的干预措施。
关于Teplizumab(PRV-031)
Teplizumab是一种在研的抗CD3单克隆抗体(mAb),已备案的生物制品许可申请正在接受FDA的优先审评,用于延缓或预防高危人群的临床1型糖尿病。在多项涉及1000多名受试者的临床研究中,已有800多名患者接受了替普利珠单抗。在以往对新诊断患者的研究中,teplizumab始终能够保留β细胞的功能(衡量内源性胰岛素产生的一种方法),并相应地减少了对外源性胰岛素的使用。Teplizumab已被FDA授予突破性疗法称号,并被欧洲药品管理局授予PRIME称号。
参考资料:1. Moleculin Announces Annamycin Receives FDA Orphan Drug Designation for Soft Tissue Sarcomas 2.An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
