FDA已授予抗TIGIT疗法tiragolumab突破性疗法称号,与阿替利珠单抗(atezolizumab,Tecentriq)联合使用,用于PD-L1高表达且不携带任何EGFR或ALK突变的转移性非小细胞肺癌(NSCLC)患者的前线治疗。
该决定是基于2期CITYSCAPE试验(NCT03563716)的数据,在该试验中发现,在对化疗无反应、局部晚期或转移性NSCLC患者中,该双药方案比单药疗效更好。
2020年ASCO虚拟科学计划期间展示的主要分析结果显示,在意向治疗(ITT)人群中,每3周给药一次的双药联合方案(tiragolumab+atezolizumab)要比单药方案(atezolizumab+安慰剂)降低43%的疾病进展或死亡风险。此外,根据研究者的评估,双药方案在ITT人群中引起的总缓解率(ORR)为31%,而单药组为16%。
在中位随访10.9个月的情况下,无进展生存期(PFS)得以改善,双药组PFS中位数为5.6个月,单药组为3.9个月。ORR分别为37%与21%。
在2组盲法试验中,共135名PD-L1肿瘤比例评分(TPS)为1%或更高的参与者按照1:1随机接受静脉注射(IV)tiragolumab或安慰剂,剂量为600mg,每3周一次,与IV阿替利珠单抗联合,剂量为1200mg,每3周一次。
根据PD-L1 TPS(1-49% vs大于50%)、组织学(非鳞状vs鳞状)和吸烟史(是vs否)对患者进行分类。试验的共同主要终点是ORR和PFS。关键次要终点包括反应持续时间、总生存期和患者报告的结果,而其他探索性终点包括通过PD-L1表达高低进行的疗效评估。
按PD-L1 TPS分类时,结果如下:
ORR:在TPS为50%或更高的患者中(n = 58),使用tiragolumab/阿替利珠单抗的ORR为66%,使用安慰剂/阿替利珠单抗的ORR为24%;在TPS为1%至49%的患者中(n = 77),ORR分别为16%和18%。
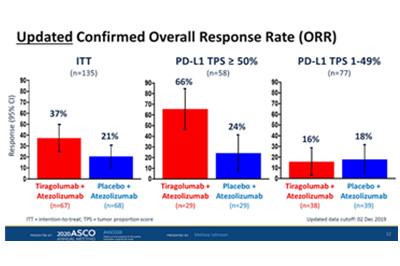 各组ORR:意向治疗人群;PD-L1高表达;PD-L1低表达(左起)
各组ORR:意向治疗人群;PD-L1高表达;PD-L1低表达(左起)
PFS:在PD-L1 TPS为50%或更高的患者组中,研究者评估的中位PFS在双药组和单药组中分别为不可评估和4.1个月。在PD-L1 TPS为1%至49%之间的组中,研究者评估的中位PFS分别为4.0个月和3.6个月。
在安全性方面,发现tiragolumab加阿替利珠单抗的耐受性良好,其毒性与阿替利珠单抗相当。在双药组中,有48%的患者报告了3-5级不良反应,而在单药组中,有44%的患者报告了3-5级不良反应,分别有5%和7%的患者出现5级毒性。
值得注意的是,tiragolumab加阿替利珠单抗与单用阿替利珠单抗相比,免疫介导的毒性报道更多,但这些影响的严重程度大多为1级或2级,并被确定为可控。
参考资料:FDA Grants Breakthrough Therapy Designation to Tiragolumab Plus Atezolizumab for PD-L1–High NSCLC
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。