




1、临床试验描述
在下表汇总的试验中评估了替诺福韦(韦立得、Vemlidy、TAF)的疗效和安全性。
表:在患有慢性HBV感染的受试者中进行的替诺福韦(韦立得、Vemlidy、TAF)试验
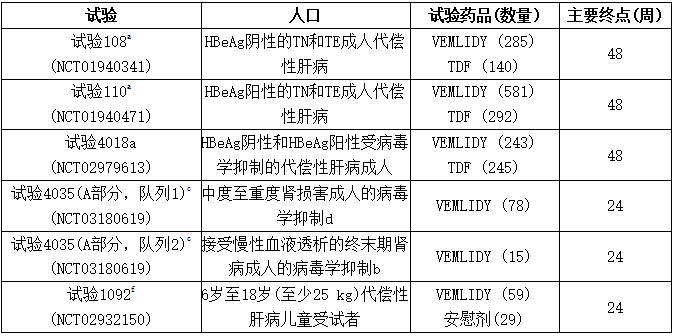
TE =接受过治疗,TN =未经治疗
a随机、双盲、活性对照试验
b筛选时HBV DNA <20国际单位/毫升
c开放标签试验
d用Cockcroft-Gault法估计肌酐清除率在每分钟15至59毫升之间
e终末期肾病(根据Cockcroft-Gault法,估计肌酐清除率低于每分钟15毫升)
f随机、双盲、安慰剂对照试验
2、成人慢性乙型肝炎病毒感染和代偿性肝病的临床试验
替诺福韦(韦立得、Vemlidy、TAF)治疗成人慢性乙型肝炎病毒感染伴代偿性肝病的疗效和安全性基于两项随机、双盲、活性对照试验[试验108 (N=425)和试验110 (N=873)]的48周数据。在两个试验中,除试验治疗外,不允许受试者接受其他核苷、核苷酸或干扰素治疗。
在试验108中,HBeAg阴性、未经治疗和接受过治疗的代偿性肝病受试者(无腹水、肝性脑病、静脉曲张出血的证据,INR < 1.5x倍ULN,总胆红素< 2.5倍ULN,白蛋白> 3.0毫克/分升)按2:1的比例随机接受替诺福韦(韦立得、Vemlidy、TAF)25毫克(N=285)每日一次或TDF300毫克(N=140)每日一次,持续48周。平均年龄为46岁,61%为男性,72%为亚洲人,25%为白人,2%为黑人,1%为其他人种。24%、38%和31%分别为HBV基因型B、C和D。21%接受过治疗[以前接受过口服抗病毒药物治疗,包括恩替卡韦(N=41)、拉米夫定(N=42)、TDF (N=21)或其他(N=18)]。基线时,平均血浆HBV DNA为5.8 log10 IU/毫升,平均血清ALT为94 U/升,9%的受试者有肝硬化病史。
在试验110中,患有代偿性肝病的HBeAg阳性、未经治疗和接受过治疗的受试者按2:1的比例被随机分配接受替诺福韦(韦立得、Vemlidy、TAF)25毫克(N=581)每日一次或TDF 300毫克(N=292)每日一次,持续48周。平均年龄为38岁,64%为男性,82%为亚洲人,17%为白人,1%为黑人或其他人种。17%、52%和23%分别为HBV基因型B、C和D。26%接受过治疗[之前接受过口服抗病毒药物治疗,包括阿德福韦(N=42)、恩替卡韦(N=117)、拉米夫定(N=84)、替比夫定(N=25)、TDF (N=70)或其他(n=17)]。基线时,平均血浆HBV DNA为7.6 log10 IU/毫升,平均血清ALT为120 U/升,7%的受试者有肝硬化病史。
在这两项试验中,随机分配按既往治疗史(核苷类药物幼稚或有经验)和基线HBV DNA (<7,≥7至< 8,以及试验108中≥8 log10 IU/毫升)分层;以及试验110中< 8和≥8 log10 IU/毫升)。两项试验的疗效终点是第48周时血浆HBV DNA水平低于29 IU/毫升的受试者比例。
其他疗效终点包括试验110中ALT正常化、HBsAg转阴和血清转化以及HBeAg转阴和血清转化的受试者比例。
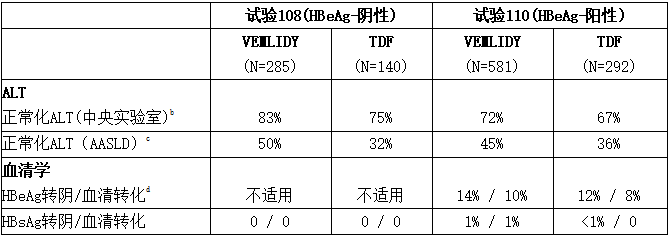
下表列出了试验108和110在第48周的治疗结果。
表:试验108和110:慢性HBV感染和代偿性肝病受试者在第48a周的HBV DNA病毒学结果

a缺失=故障分析
b按基线血浆HBV DNA类别和口服抗病毒治疗状态分层进行调整。
c未接受治疗的受试者接受了小于12周的口服抗病毒治疗,使用任何核苷或核苷酸类似物,包括TDF或替诺福韦(韦立得、Vemlidy、TAF)。
d包括因缺乏疗效、不良事件或死亡、非AE、死亡或缺乏疗效或失去疗效,如撤回同意、失去随访等,或在第48周窗口期期间数据缺失但仍在服用研究药物而停用的受试者。
在试验108中,替诺福韦(韦立得、Vemlidy、TAF)组中第48周时达到HBV DNA <29 IU/毫升的肝硬化受试者比例为92% (22/24),TDF组中为93% (13/14)。替诺福韦(韦立得、Vemlidy、TAF)组和TDF组在试验110中的相应比例分别为63% (26/41)和67% (16/24)。
表:第48a周的其他疗效参数
N/A=不适用
a缺失=故障分析。
b用于ALT正常化分析的人群仅包括ALT高于中心实验室范围的正常上限(ULN)的受试者(18至小于69岁的男性>43U/升,大于等于69岁的男性>35 U/升;18至小于69岁女性>34U/升,大于等于69岁女性>32U/升)。
c用于分析ALT正常化的人群仅包括基线时ALT高于2016年美国肝病研究协会(AASLD)标准的ULN(男性>30 U/升,女性>19 U/升)的受试者。
d用于血清学分析的人群仅包括抗原(HBeAg)阳性和抗体(HBeAb)阴性或缺失的受试者。
3、在病毒学抑制的成人慢性乙型肝炎病毒感染患者中转而接受替诺福韦(韦立得、Vemlidy、TAF)治疗的临床试验
在病毒学受到抑制的成人慢性乙型肝炎病毒感染中,从TDF转用替诺福韦(韦立得、Vemlidy、TAF)的疗效和安全性基于一项随机、双盲、活性对照试验(试验4018)(N = 488)的48周数据。受试者必须已服用TDF 300毫克,每日一次至少12个月,筛选前至少12周HBV DNA低于当地实验室评估的定量下限,筛选时HBV DNA <20 IU/毫升。受试者按HBeAg状态(HBeAg-阳性或HBeAg-阴性)和年龄(≥50岁或< 50岁)分层,并按1:1的比例随机分配到替诺福韦(韦立得、Vemlidy、TAF)25毫克每日一次(N = 243)或继续服用TDF 300毫克每日一次(N=245)。平均年龄为51岁(22%为≥60岁),71%为男性,82%为亚洲人,14%为白人,68%为HBeAg阴性。在基线时,替诺福韦(韦立得、Vemlidy、TAF)组和TDF组先前TDF治疗的中位持续时间分别为220周和224周。基线时,平均血清ALT为27 U/升,16%的受试者有肝硬化病史。
主要疗效终点是第48周时血浆HBV DNA水平≥20 IU/毫升的受试者比例。试验4018中的其他疗效终点包括HBV DNA <20 IU/毫升、ALT正常和正常化、HBsAg转阴和血清转化以及HBeAg转阴和血清转化的受试者比例。
下表列出了试验4018在第48周的治疗结果。
表:试验4018:病毒学抑制的慢性HBV感染受试者在第48a周的HBV DNA病毒学结果
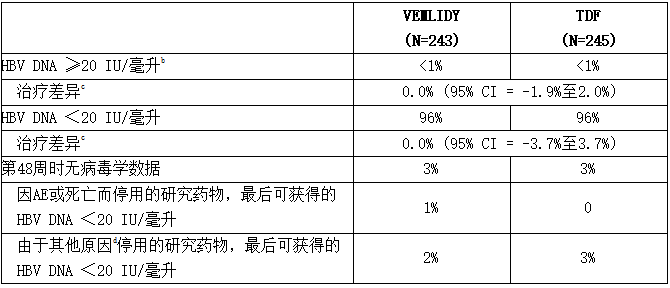
a第48周的窗口期为第295天至第378天(含)。
b无受试者因缺乏疗效而中止治疗。
c按基线年龄组(< 50岁、≥ 50岁)和基线HBeAg状态分层进行调整。
d包括因AE、死亡或缺乏疗效以外的原因(如撤回同意、失访等)中止治疗的受试者。
表:第48a周的其他疗效参数(试验4018)
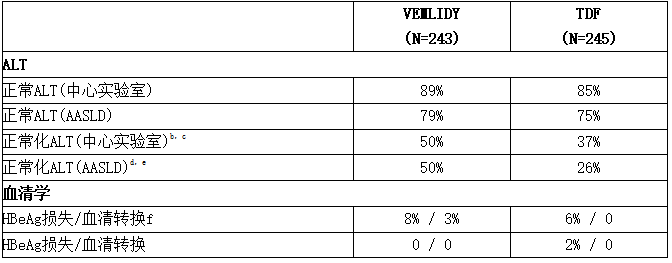
a缺失=故障分析。
b用于分析ALT正常化的人群仅包括ALT高于中心实验室检测范围正常上限(ULN)的受试者(大于18至小于69岁男性> 43 U/升,大于等于69岁男性> 35 U/升;18至小于69岁的女性> 34 U/升,大于等于69岁的女性> 32 U/升)。
c第48周时的受试者比例:替诺福韦(韦立得、Vemlidy、TAF),16/32;TDF,7/19。
d用于分析ALT正常化的人群仅包括基线时ALT高于2018年美国肝病研究协会(AASLD)标准ULN的受试者(男性:35 U/升;女性:25 U/升)。
e第48周时的受试者比例:替诺福韦(韦立得、Vemlidy、TAF),26/52;TDF,14/53。
f用于血清学分析的人群仅包括基线时抗原(HBeAg)阳性和抗体(HBeAb)阴性或缺失的受试者。
4、成人慢性乙型肝炎病毒感染并肾功能损害的临床试验
在试验4035的A部分中,在一项开放标签临床试验中评估了从 TDF 和/或其他抗病毒药物转用替诺福韦(韦立得、Vemlidy、TAF)的疗效和安全性,受试者为中度至重度肾功能损害(按 Cockcroft-Gault 法估计肌酐清除率在每分钟15至59毫升之间)或 ESRD(按 Cockcroft-Gault 法估计肌酐清除率低于每分钟15毫升)的慢性乙型肝炎感染成人(队列1,78人)或接受血液透析的ESRD(按Cockcroft-Gault法估算的肌酐清除率低于每分钟15毫升)成人(队列2,15人)。 基线时,A 组中 98% 的受试者基线 HBV DNA 小于 20 IU/毫升。中位年龄为65岁,74%为男性,77%为亚洲人,16%为白人,83%为HBeAg阴性。曾接受口服抗病毒药物治疗的患者包括TDF(队列 1,57人;队列 2,1人)、拉米夫定(46人)、阿德福韦酯(46人)和恩替卡韦(43人)。基线时,根据中心实验室标准和2018年AASLD标准,分别有97%和95%的受试者ALT≤ULN;按Cockcroft-Gault法估算的肌酐清除率中位数为每分钟43毫升(队列1为每分钟45毫升,队列2为每分钟7毫升);34%的受试者有肝硬化病史。
总体而言,98% 的受试者在第 24 周达到 HBV DNA <20 IU/毫升(队列 1,97%;队列 2,100%)。队列 1 中有两名受试者提前终止了治疗(由于受试者的决定);这两名受试者的最后一次 HBV DNA 均小于 20 IU/毫升。第 24 周时,ALT 值与基线相比的总体平均(标度)变化为 +1 (11.3) U/升(队列 1, +1 [11.9] U/升;队列 2, +3 [7.9] U/升)。没有受试者在第 24 周时出现 HBeAg 或 HBsAg 下降。第24周时,HBsAg水平与基线相比的平均(标度)变化为-0.05 (0.122) log10 IU/毫升(队列1为-0.05 [0.124] log10 IU/毫升,队列2为-0.07 [0.115] log10 IU/毫升)。
5、6岁及以上慢性乙型肝炎病毒感染儿童受试者的临床试验
在试验1092中,对替诺福韦(韦立得、Vemlidy、TAF)在慢性 HBV 感染者中的疗效和安全性进行了随机、双盲、安慰剂对照临床试验评估,试验对象为年龄在 12 岁至 18 岁以下、体重至少 35 千克(队列 1;N=70)和 6 岁至 12 岁以下、体重至少 25 千克(队列 2,第 1 组;N=18)的未接受过治疗和接受过治疗的受试者。受试者被随机分配接受替诺福韦(韦立得、Vemlidy、TAF) (N=59)或安慰剂(N=29),每日一次。替诺福韦(韦立得、Vemlidy、TAF)治疗组和安慰剂组之间的基线人口统计学和HBV病特征具有可比性:替诺福韦(韦立得、Vemlidy、TAF)组中,58%为男性,63%为亚洲人,27%为白人;9%、24%、22%和44%分别为HBV基因型A、B、C和D;98%为HBeAg阳性。基线时,HBV DNA总中位值为8.1 log10 IU/毫升,平均ALT为107 U/L,HBsAg中位值为4.5 log10 IU/毫升。既往治疗包括口服抗病毒药物(N=20 [23%]),包括恩替卡韦(N=10 [11%]、拉米夫定(N=10 [11%])和TDF (N=2 [2%])和/或干扰素(N=13 [15%])。
第24、48和96周HBV DNA < 20 IU/毫升的每个治疗组和队列的结果见下表。
表:试验1092:6岁及以上慢性HBV病儿童受试者的HBV DNA病毒学结果
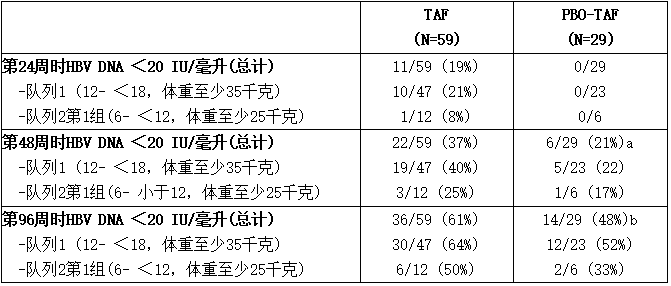
a替诺福韦(韦立得、Vemlidy、TAF)第24周
b替诺福韦(韦立得、Vemlidy、TAF)第72周
第96周时,接受替诺福韦(韦立得、Vemlidy、TAF)治疗的受试者和从安慰剂转换为替诺福韦(韦立得、Vemlidy、TAF)的受试者的HBV DNA自基线的总体平均(SD)变化分别为-6.18 (1.495) log10 IU/毫升和-5.92 (1.775) log10 IU/毫升。第96周时,替诺福韦(韦立得、Vemlidy、TAF)和安慰剂-替诺福韦(韦立得、Vemlidy、TAF)治疗组ALT值自基线的总中位变化分别为-39.5 U/升和-46.5 U/升。54%接受替诺福韦(韦立得、Vemlidy、TAF)治疗的受试者和57%从安慰剂转换为替诺福韦(韦立得、Vemlidy、TAF)的受试者达到ALT正常化(AASLD标准)。
在第96周,接受替诺福韦(韦立得、Vemlidy、TAF)治疗的58名受试者中有14名(24%)以及从安慰剂转换为替诺福韦(韦立得、Vemlidy、TAF)的29名受试者中有5名(17%)出现了HBeAg丢失和抗HBe血清转化。队列1替诺福韦(韦立得、Vemlidy、TAF)组中的47名受试者中有1名在第96周时达到HBsAg转阴。
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表医伴旅立场,亦不代表医伴旅支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2024年03月27日的说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=208464