米哚妥林(Midostaurin)是一种酪氨酸激酶抑制剂。许多癌细胞的生长、增殖和转移都依赖于异常的酪氨酸激酶活性。米哚妥林通过特异性地抑制多种酪氨酸激酶的活性,阻断这些激酶介导的信号传导通路,抑制肿瘤细胞的增殖和扩散。
药品称呼
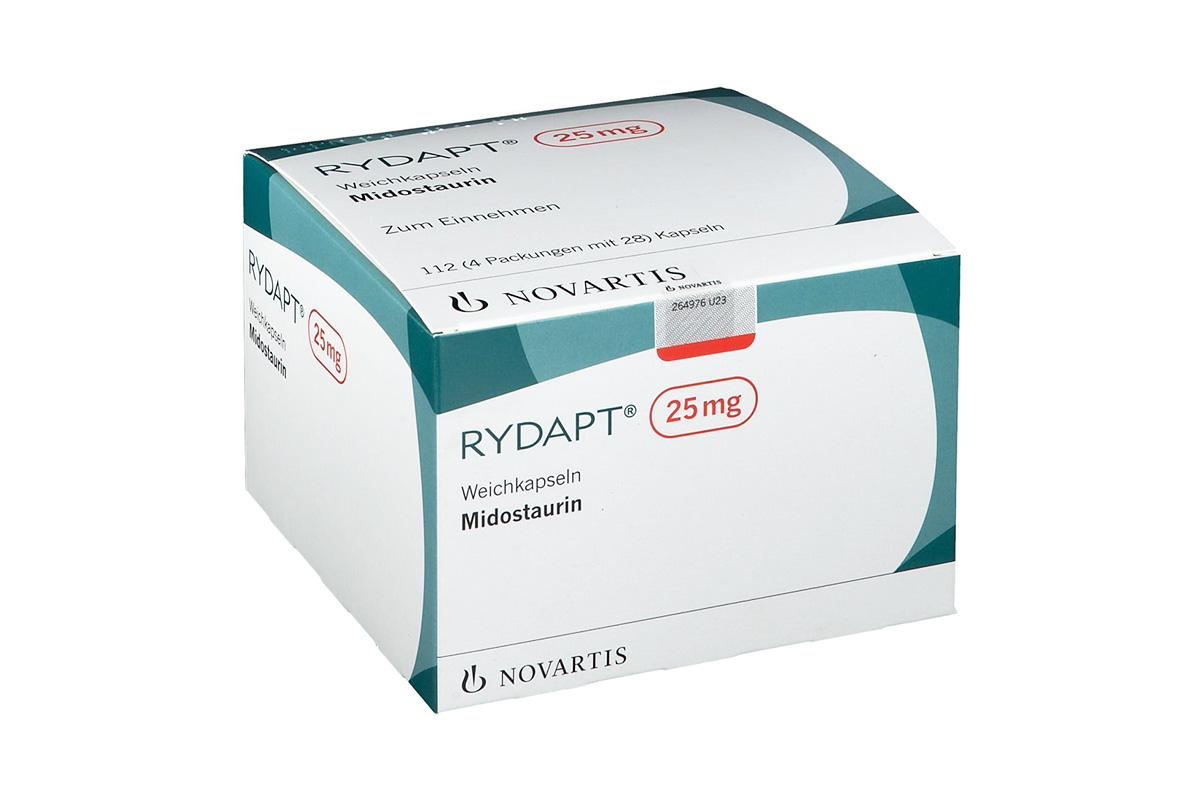
通用名称:米哚妥林、Midostaurin
商品名称:Rydapt
适应靶点
米哚妥林及其主要人体活性代谢产物(CGP62221、CGP52421)可抑制多种靶点激酶活性,具体包括:
FLT3:野生型FLT3、FLT3突变型激酶(含内部串联重复突变ITD、酪氨酸激酶结构域突变TKD);
KIT:野生型KIT、KITD816V突变型;
PDGFR家族:血小板衍生生长因子受体α/β(PDGFRα/β);
PKC家族:蛋白激酶C(serine/threonine kinasePKC)家族成员。
适应症与适用人群
1、急性髓系白血病
米哚妥林适用于与标准阿糖胞苷和柔红霉素诱导化疗及阿糖胞苷巩固化疗联合,治疗经FDA批准检测方法确认FLT3突变阳性的新诊断成人急性髓系白血病(AML)患者。米哚妥林不可作为单药诱导疗法用于治疗AML患者。
2、系统性肥大细胞增多症
米哚妥林适用于治疗成人侵袭性系统性肥大细胞增多症(ASM)、伴有相关血液肿瘤的系统性肥大细胞增多症(SM-AHN)或肥大细胞白血病(MCL)患者。
规格和性状
规格:胶囊,25mg*112粒/盒;
性状:呈淡橙色椭圆形软胶囊,用红色墨水印有“PKCNVR”。
主要成分
Midostaurin
用法用量
1、急性髓系白血病推荐剂量
AML患者的米哚妥林推荐剂量为50mg口服,每日两次,随餐服用,在阿糖胞苷和柔红霉素诱导化疗的每个周期第8至21天以及大剂量阿糖胞苷巩固化疗的每个周期第8至 21天给药。
2、ASM、SM-AHN和MCL推荐剂量
ASM、SM-AHN和MCL患者的米哚妥林推荐剂量为100mg口服,每日两次,随餐服用。持续治疗直至疾病进展或出现不可接受的毒性。治疗期间,前4周至少每周监测一次毒性,接下来8周每两周监测一次,之后每月监测一次。
3、给药方法
治疗前给予预防性止吐药,以降低恶心和呕吐风险。
米哚妥林需随餐口服,每日两次,间隔约12小时。不得打开或压碎胶囊。
若漏服或呕吐,无需补服,按常规时间服用下一剂。
若米哚妥林与可能延长QT间期的药物联用,需考虑通过心电图(ECG)定期评估QT间期。具体您可以阅读米哚妥林完整用法用量信息,建议在医生的指导下正确用药。推荐文章:米哚妥林的用法用量。
不良反应
1.急性髓系白血病(AML)患者不良反应
在AML临床研究中,米哚妥林(50mg每日两次,联合化疗)组患者中位暴露时长为42天,常见不良反应及严重程度如下:
≥20%的常见不良反应:发热性中性粒细胞减少(83%)、恶心(83%)、黏膜炎(66%)、呕吐(61%)、头痛(46%)、瘀点(36%)、肌肉骨骼疼痛(33%)、鼻出血(28%)、器械相关感染(24%)、高血糖(20%)、心电图QT间期延长(20%)、上呼吸道感染(20%)。
≥10%的3/4级不良反应:发热性中性粒细胞减少(84%)、器械相关感染(16%)、黏膜炎(11%)。
2.ASM、SM-AHN和MCL患者不良反应
在ASM、SM-AHN及MCL临床研究中,米哚妥林(100mg每日两次,单药)组患者中位暴露时长为11.4个月,34%的患者治疗时长≥24个月,常见不良反应及严重程度如下:
≥20%的常见不良反应:恶心(82%)、呕吐(68%)、腹泻(54%)、水肿(40%)、肌肉骨骼疼痛(35%)、腹痛(34%)、疲劳(34%)、上呼吸道感染(30%)、便秘(29%)、发热(27%)、头痛(26%)、呼吸困难(23%)。
更多上市后不良反应以及实验室异常请参照完整说明书,具体您可以阅读米哚妥林完整副作用信息,建议在医生的指导下正确用药。推荐文章:米哚妥林的副作用。
注意事项
1.胚胎-胎儿毒性
告知孕妇米哚妥林对胎儿的潜在风险。有生殖潜力的女性患者,需在开始米哚妥林治疗前7天内确认妊娠状态。
有生殖潜力的女性患者在治疗期间及末次给药后4个月内,需使用有效的避孕措施;有生殖潜力女性伴侣的男性患者,在治疗期间及末次给药后4个月内,也需使用有效的避孕措施。
2.肺毒性
米哚妥林单药治疗或联合化疗时,可能发生间质性肺病或肺炎,部分病例可致命。
治疗期间需密切监测患者是否出现咳嗽、胸痛、呼吸困难等肺毒性相关症状。
若患者出现疑似间质性肺病或肺炎的症状,且排除感染因素后,需立即停用米哚妥林。
3.儿童联用化疗的风险
儿童患者使用米哚妥林(未获批剂型)联合化疗(含蒽环类、氟达拉滨、阿糖胞苷)时,可能出现长期严重的4级中性粒细胞减少和血小板减少;若同时联用唑类抗真菌药(强CYP3A4抑制剂),可能增加米哚妥林暴露量,进一步升高毒性风险。
米哚妥林在儿童患者中的安全性和有效性尚未确立,不推荐儿童使用。
4.给药相关注意事项
必须随餐服用,以稳定药物暴露量,避免空腹给药导致的吸收波动。
胶囊需整粒吞服,不可打开或压碎,防止药物成分暴露影响疗效或增加局部刺激。
漏服或呕吐后无需补服,避免因剂量叠加增加不良反应风险。
与其他药物联用时,需提前评估药物相互作用(尤其影响CYP3A4代谢或QT间期的药物),必要时调整剂量或监测相关指标(如ECG、血药浓度)。
特殊人群用药
【孕妇】基于作用机制和动物研究,米哚妥林可能对胎儿造成伤害,孕妇禁用。建议孕妇注意胎儿的潜在风险,有生殖潜力的女性在治疗前7天内确认妊娠状态,并在治疗期间及停药后4个月采取有效避孕措施。
【哺乳期女性】目前尚无米哚妥林及其活性代谢产物在人乳中的存在、对母乳喂养婴儿的影响或对乳汁产生影响的数据。由于米哚妥林可能对母乳喂养的婴儿造成严重不良反应,建议女性在治疗期间及最后一剂后4个月不要母乳喂养。
【具有生殖潜力的男性和女性】米哚妥林可能对胎儿造成伤害,有生殖潜力的女性在治疗期间及停药后4个月应使用有效避孕措施,有生殖潜力女性伴侣的男性在治疗期间及停药后4个月也应使用有效避孕措施。
【儿童使用】米哚妥林在儿科患者中的安全性和有效性尚未确立。
【老年人使用】65岁及以上患者与年轻患者在安全性或缓解率方面未观察到总体差异,但不能排除老年人更为敏感的可能性。
【肾功能损害】轻度(总胆红素>1.0至1.5倍ULN或AST>ULN)或中度(总胆红素1.5至3.0倍ULN且AST为任何值)肾功能损害及肌酐清除率(CLCr)≥30mL/min的患者,米哚妥林、CGP62221或CGP52421的药代动力学无临床意义的影响。严重肾功能损害(CLCr15至29mL/min)患者的米哚妥林药代动力学未知。
【肝功能损害】轻度(总胆红素>1.0至1.5倍ULN或AST>ULN)或中度(总胆红素1.5至3.0倍ULN且AST为任何值)肝功能损害患者,米哚妥林、CGP62221或CGP52421的药代动力学无临床意义的影响。
禁忌症
对米哚妥林或任何辅料存在过敏的患者禁用本品。过敏反应包括过敏性休克、呼吸困难、潮红、胸痛和血管性水肿(如气道或舌头肿胀,伴或不伴呼吸障碍)。
药物相互作用
1.其他药物对米哚妥林的影响
强CYP3A4抑制剂:与强CYP3A4抑制剂合用可能增加米哚妥林及其活性代谢产物的暴露量。应考虑使用不强烈抑制CYP3A活性的替代疗法,或在合用米哚妥林与强CYP3A4抑制剂时,监测患者的不良反应风险增加情况。
CYP3A4诱导剂:与强CYP3A4诱导剂合用可能降低米哚妥林及其活性代谢产物的暴露量,进而可能降低疗效。应避免米哚妥林与强CYP3A4诱导剂合用。
2.米哚妥林对其他药物的影响
CYP2B6底物:米哚妥林可降低敏感CYP2B6底物的全身暴露量,与米哚妥林合用时,可能需要对合用的CYP2B6底物进行剂量调整。
转运体底物:米哚妥林与乳腺癌耐药蛋白(BCRP)和有机阴离子转运多肽(OATP)1B1底物合用可增加这些底物的暴露量,与米哚妥林合用时,可能需要对合用的BCRP或OATP1B1底物进行剂量调整。
药物过量
说明书中尚未明确。
药代动力学
吸收:达峰时间(Tmax):空腹状态下,米哚妥林的Tmax为给药后1-3小时。
分布:表观分布容积(Vd):几何均值为95.2L(变异系数31%)。米哚妥林及其活性代谢产物在体外的血浆蛋白结合率均>99.8%,其中米哚妥林主要与α1-酸性糖蛋白结合。体外研究显示,米哚妥林及其活性代谢产物主要分布于血浆中。
消除:半衰期(t1/2):米哚妥林的几何均值终末半衰期为19小时(变异系数39%),CGP62221为32小时(变异系数31%),CGP52421为482小时(变异系数25%)。
代谢:米哚妥林主要经CYP3A4酶代谢。CGP62221和CGP52421是主要的人体活性代谢产物,分别占总循环放射性的28±2.7%和38±6.6%。
排泄:粪便排泄是主要排泄途径,占回收剂量的95%(其中91%为代谢产物,4%为原型药物);尿液排泄仅占回收剂量的5%。
特殊人群药代动力学:年龄(20-94岁)、性别、种族:对米哚妥林及其活性代谢产物的药代动力学无临床意义的影响。
肝肾功能损害:轻中度肝功能损害(总胆红素≤3.0×ULN)、肾功能损害(CLCr≥30mL/min)患者,药代动力学无临床意义的改变;严重肝肾功能损害患者数据未明确。
贮存方法
储存温度为20°C至25°C(68°F至77°F),允许在15°C至30°C(59°F至86°F)之间波动,需存放在原容器中以防潮。
研发公司
瑞士诺华