帕尼单抗是一种全人源化IgG2κ单克隆抗体,靶向表皮生长因子受体(EGFR),通过竞争性抑制EGFR与其配体的结合,阻断下游信号通路,从而抑制肿瘤细胞生长、诱导凋亡,并降低炎性细胞因子与血管生长因子的产生。本品适用于经FDA批准的检测方法确认的野生型RAS(包括KRAS和NRAS)转移性结直肠癌(mCRC)患者,以及KRASG12C突变mCRC患者(需与索托拉西布联合使用)。
药品称呼
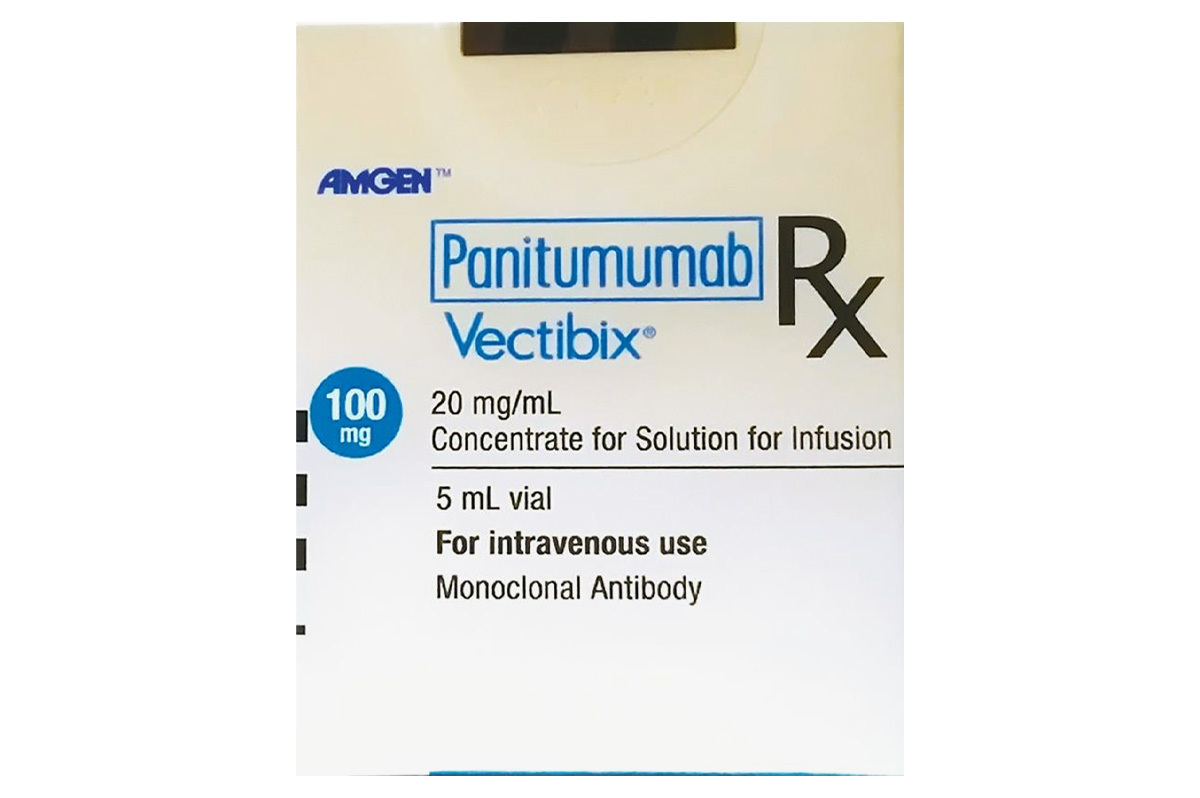
通用名称:帕尼单抗、Panitumumab
商品名称:Vectibix
适应靶点
表皮生长因子受体(EGFR)。
适应症和适应人群
适应症:
野生型RAS转移性结直肠癌(mCRC):与FOLFOX方案联合用于一线治疗。作为单药治疗,用于既往接受过含氟嘧啶、奥沙利铂和伊立替康的化疗后疾病进展的患者。
KRASG12C突变转移性结直肠癌(mCRC):与索托拉西布联合,用于既往接受过含氟嘧啶、奥沙利铂和伊立替康化疗的成年患者。
适应人群:
成年患者,需经FDA批准的检测方法确认肿瘤RAS状态。
使用限制:
除非与索托拉西布联合用于KRASG12C突变mCRC,否则不适用于RAS突变mCRC患者。
不适用于RAS突变状态不明的mCRC患者。
规格与性状
规格:100mg/5mL/盒。
性状:无色溶液,可能含有少量半透明至白色、无定形蛋白颗粒。pH范围为5.6–6.0。
主要成分
每5mL瓶含:帕尼单抗100mg、醋酸钠34mg、氯化钠29mg、注射用水。
用法用量
患者选择
在开始帕尼单抗单药治疗前,必须评估结直肠肿瘤的RAS突变状态,确认KRAS和NRAS的外显子2、3、4中无突变。
推荐剂量
野生型RASmCRC:6mg/kg,每14天一次,静脉输注60分钟(≤1000mg)或90分钟(>1000mg),直至疾病进展或出现不可耐受毒性。
KRASG12C突变mCRC:6mg/kg,每14天一次,静脉输注60分钟(≤1000mg)或90分钟(>1000mg),与索托拉西布联合使用。首次索托拉西布给药应在首次帕尼单抗输注前进行。
剂量调整
与索托拉西布联合使用时:若索托拉西布暂停或永久停用,应相应暂停或永久停用帕尼单抗。
输液反应:
轻中度反应:输注速率降低50%。
严重反应:立即停止输注,并考虑永久停用帕尼单抗。
皮肤毒性:
首次出现3级反应:暂停1–2剂;恢复后按原剂量重启。
第二次出现3级反应:暂停1–2剂;恢复后按原剂量的80%重启。
第三次出现3级反应:暂停1–2剂;恢复后按原剂量的60%重启。
第四次出现3级反应:永久停用。
4级反应或3级反应在暂停1–2剂后未恢复:永久停用。
具体您可以阅读帕尼单抗完整用法用量信息,建议在医生的指导下正确用药。推荐文章:帕尼单抗的用法用量。
不良反应
最常见不良反应(≥20%)
单药治疗:皮疹(表现形式多样)、甲沟炎、疲劳、恶心、腹泻。
与FOLFOX联合:腹泻、口腔炎、黏膜炎、乏力、甲沟炎、厌食、低镁血症、低钾血症、皮疹、痤疮样皮炎、瘙痒、皮肤干燥。
与索托拉西布联合:皮疹、皮肤干燥、腹泻、口腔炎、疲劳、肌肉骨骼疼痛。
严重不良反应
皮肤与软组织毒性(包括坏死性筋膜炎、脓肿、败血症);输液反应(包括致死性反应);急性肾衰竭;间质性肺病(ILD)/肺纤维化;角膜炎、溃疡性角膜炎、角膜穿孔;电解质紊乱(低镁血症、低钙血症、低钾血症)。
上市后报告
皮肤坏死、血管性水肿、大疱性黏膜皮肤疾病、输液反应、角膜炎/溃疡性角膜炎、角膜穿孔。
具体您可以阅读帕尼单抗副作用信息,建议在医生的指导下正确用药。推荐文章:帕尼单抗的副作用。
注意事项
皮肤与软组织毒性
90%以上患者可能出现,严重者占15%。
监测感染或炎症并发症(如坏死性筋膜炎、败血症)。
出现严重或危及生命的毒性应暂停或永久停用。
RAS突变mCRC患者的肿瘤进展与死亡风险增加
帕尼单抗单药或与奥沙利铂类化疗联合不适用于RAS突变患者,可能导致肿瘤进展加速、死亡风险增加或无临床获益。
电解质消耗与监测
可引起进行性血镁下降,导致严重低镁血症。治疗前、治疗期间及治疗后8周内定期监测镁、钙、钾等电解质水平,并及时补充。
输液反应
表现为发热、寒战、呼吸困难、支气管痉挛、低血压。严重反应需立即停止输注并永久停用。
急性肾衰竭
严重腹泻和脱水可能导致急性肾衰竭。监测腹泻与脱水症状,必要时暂停给药并给予支持治疗。
肺纤维化/间质性肺病
可能出现致死性或非致死性ILD。如出现急性或进行性肺部症状,应中断治疗;确诊ILD则永久停用。
光敏性
阳光暴露可能加重皮肤毒性,建议患者使用防晒霜、戴帽子并限制日晒。
眼部毒性
可能引起角膜炎、溃疡性角膜炎、角膜穿孔。如出现急性或进行性眼部症状,应中断或停用治疗。
与贝伐珠单抗和化疗联合时的死亡与毒性增加
帕尼单抗与贝伐珠单抗及化疗联合使用可能导致总生存期缩短、≥3级不良反应发生率增加。
胚胎-胎儿毒性
可能对胎儿造成伤害,育龄期女性治疗期间及末次给药后2个月内应采取有效避孕措施。
特殊人群用药
【孕妇】基于作用机制与动物数据,可能引起胎儿损害。建议孕妇告知医护人员已知或疑似妊娠情况。
【哺乳期女性】尚无帕尼单抗是否进入人乳的数据。建议治疗期间及末次给药后2个月内停止哺乳。
【具有生殖潜力的男性和女性】育龄期女性治疗期间及末次给药后2个月内应采取有效避孕措施。动物研究显示可能降低女性生育力,停药后可逆。
【儿童使用】安全性与有效性尚未确立。
【老年人使用】单药治疗中未观察到整体安全性或疗效差异。与FOLFOX联合时,≥65岁患者严重不良事件(尤其是腹泻)发生率更高。与索托拉西布联合时,老年人与年轻患者安全性相似。
【肾功能损害】轻中度肾功能损害(CrCL30–89mL/min)患者无需调整剂量。重度肾功能损害患者数据尚未明确。
【肝功能损害】轻中度肝功能损害(总胆红素≤3×ULN,任何AST)患者无需调整剂量。重度肝功能损害患者数据尚未明确。
禁忌症
尚不明确。
药物相互作用
说明书中尚未明确。
药物过量
剂量达到推荐治疗剂量约2倍(12mg/kg)时,可能出现皮肤毒性、腹泻、脱水、疲劳等不良反应。应停药并给予支持治疗。
药代动力学
帕尼单抗呈非线性药代动力学特征。
推荐剂量下,第三次输注后达稳态,平均峰浓度213±59μg/mL,平均谷浓度39±14μg/mL。
平均半衰期约7.5天(范围3.6–10.9天)。
年龄、性别、种族、轻中度肝肾功能损害、EGFR表达强度对药代动力学无显著影响。
贮存方法
原包装冷藏于2–8°C,避光保存。禁止冷冻或振摇。开封后未使用部分应丢弃。
研发公司
美国安进公司