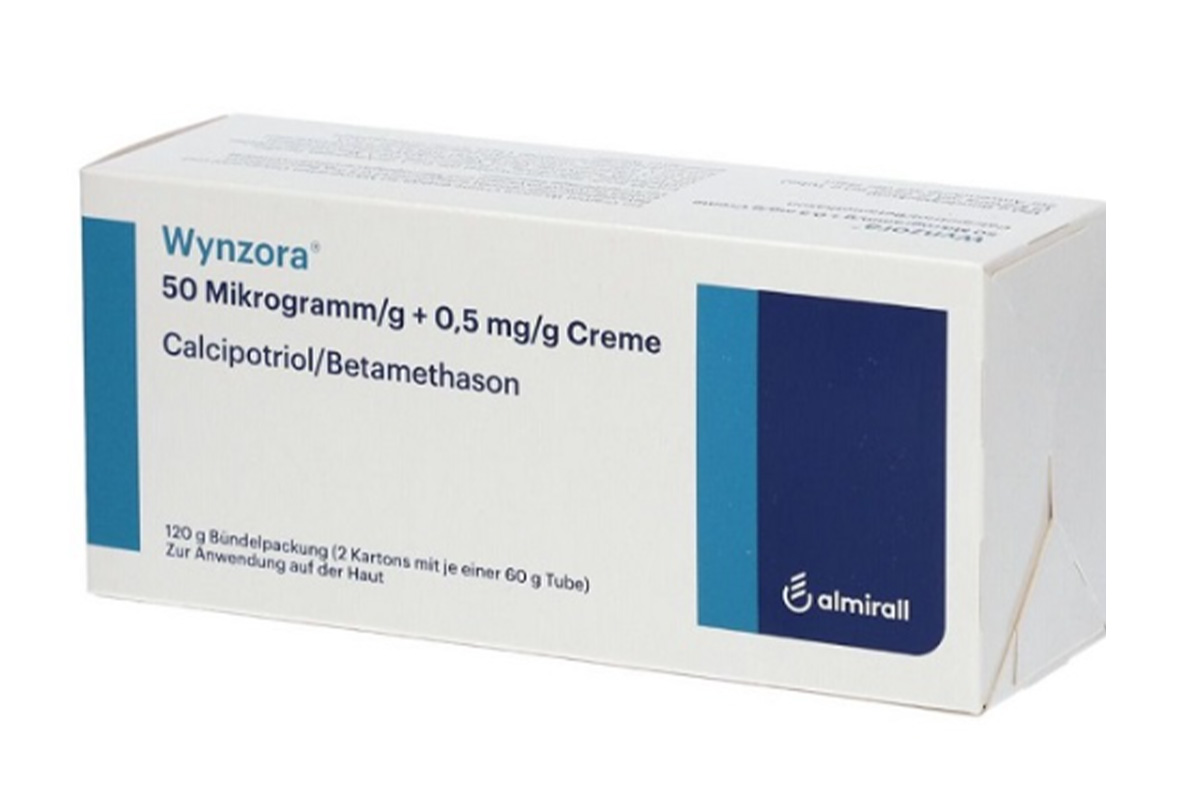
Wynzora乳膏是一种用于治疗斑块型银屑病的局部用药,适用于18岁及以上的斑块型银屑病患者。用于减少斑块状牛皮癣的治疗中断,提高患者满意度。
药品称呼
通用名称:卡泊三醇/二丙酸倍他米松、calcipotriene and betamethasone dipropionate
商品名称:Wynzora
适应靶点
角质形成细胞、免疫细胞等中的维生素D受体(VDR,卡泊三醇作用)与糖皮质激素受体(GR,二丙酸倍氯米松作用)。
适应症和适应人群
适用于18周岁及以上、经临床确诊为斑块型银屑病,且需通过局部用药控制皮损的患者。
规格与性状
规格
60g*2管/盒。
性状
白色乳膏,质地均匀,无明显颗粒感或异味。
主要成分
活性成分:卡泊三醇、二丙酸倍氯米松。
用法用量
药品应用:将Wynzora软膏涂抹于银屑病斑块患处,每日1次,最长用药疗程为8周;涂抹后需轻柔揉搓,确保药膏充分覆盖并渗透斑块组织。
停药时机:当银屑病症状(如斑块厚度、红斑、鳞屑)得到临床控制后,应立即停止治疗,无需继续维持用药,除非医生根据患者病情另有指导。
剂量限制:每周用药总量不得超过100克,避免因过量用药增加系统不良反应风险。
具体您可以阅读Wynzora软膏(二丙酸倍他米松/卡泊三醇)完整用法用量信息,建议在医生的指导下正确用药。推荐文章:Wynzora软膏的用法用量。
不良反应
常见不良反应(发生率≥1%且高于安慰剂组)
全身不良反应:上呼吸道感染(包括鼻咽炎、病毒性上呼吸道感染等亚型,发生率7%)、头痛(发生率2%),上述反应多为轻度至中度,与药物直接关联度尚需结合患者基础健康状况判断。
局部不良反应:用药部位刺激(发生率1%),表现为局部红斑、瘙痒、烧灼感,通常在用药初期出现,多数患者可耐受或随用药时间缓解。
具体您可以阅读Wynzora软膏(二丙酸倍他米松/卡泊三醇)不良反应完整内容,建议在医生的指导下正确用药。推荐文章:Wynzora软膏的不良反应。
注意事项
高钙血症与高钙尿症监测
用药时监测钙代谢,若血钙>2.75mmol/L(高钙血症)或24小时尿钙>7.5mmol(高钙尿症),需立即停药至指标正常,并定期复查防肾损伤。
内分泌系统影响防控
wynzora软膏含中强效皮质类固醇,可能抑制HPA轴(大面积/长期用、皮肤屏障受损时风险更高)。怀疑抑制时用ACTH刺激试验评估肾上腺功能并调方案,勿突然停药(防肾上腺功能不全)。不与其他皮质类固醇联用(防库欣综合征、高血糖)。
过敏性接触性皮炎应对
局部用皮质类固醇可能引发“治疗无效”型过敏,需斑贴试验确诊并换药。对卡泊三醇过敏者(表现为瘙痒、红斑加重)禁用wynzora软膏。
眼部安全防护
严禁药物接触眼部,意外接触需立即冲洗.用药时若出现视力模糊、眼痛,应及时转诊眼科排查眼部疾病。
其他重要提示
用药后需彻底洗手(防残留接触敏感部位)。不可用于皮肤感染性疾病(防加重感染)。开封后未用药物需6个月内丢弃。
特殊人群用药
【孕妇】缺乏足够数据评估Wynzora软膏对孕妇及胎儿的安全性,但高剂量局部皮质类固醇可能增加胎儿低出生体重风险,动物实验显示卡泊三醇和倍他米松可能导致胎儿异常。仅在医生评估母体获益大于胎儿风险时使用,严格限制用药面积和疗程,避免每周用量超过100克。
【哺乳期女性】尚不清楚Wynzora软膏是否通过母乳分泌及其对乳儿的影响,尽管系统吸收量低,但仍需谨慎。仅在医生评估母体获益大于乳儿风险时使用,严禁涂抹于乳头、乳晕区域,并在哺乳前彻底清洗用药部位皮肤。
【具有生殖潜力的男性和女性】目前无明确数据支持Wynzora软膏对生殖功能的影响,建议此类人群在医生指导下使用,无需特殊剂量调整,但需关注常规不良反应。
【儿童使用】18岁以下儿童的安全性和有效性尚未确立,儿童皮肤表面积与体重比值较高,易发生系统毒性反应(如HPA轴抑制、库欣综合征等)和局部皮肤萎缩。不推荐18岁以下患者使用,除非医生评估后认为必要,并密切监测生长发育及内分泌功能。
【老年人使用】临床研究未发现老年患者与年轻患者在安全性或有效性上有显著差异,但部分老年患者因皮肤屏障功能减退或合并基础疾病,可能对药物更敏感。无需调整剂量,但需加强监测,特别是皮肤萎缩和高血糖等不良反应。
【肾功能损害】目前无相关药代动力学或临床研究数据,鉴于系统吸收量低,肾功能损害对药物排泄影响较小。建议在医生指导下使用,无需常规调整剂量,但需监测钙代谢指标。
【肝功能损害】肝功能损害是HPA轴抑制的风险因素之一,肝功能损害患者需严格遵医嘱,限制用药面积和疗程,并定期监测肾上腺功能、钙代谢指标及肝功能。出现异常及时调整用药方案。
禁忌症
目前尚无明确的禁忌症。
药物相互作用
1.避免与其他局部外用皮质类固醇药物(如糠酸莫米松乳膏、卤米松乳膏)或卡泊三醇类药物(如卡泊三醇软膏)联用,否则会增加皮质类固醇或卡泊三醇的系统暴露量,提升HPA轴抑制、高钙血症等风险。
2.若患者同时使用其他局部外用药物(如保湿剂、抗真菌药),建议与本品间隔1-2小时使用,避免药物在皮肤表面相互作用,影响吸收或疗效。
3.全身用药(如口服皮质类固醇、维生素D补充剂)与本品联用时,需医生评估获益与风险,口服皮质类固醇可能叠加HPA轴抑制风险,维生素D补充剂可能增加高钙血症风险。
药物过量
尚不明确。
药代动力学
吸收:本品局部外用后,药物经皮肤吸收量极少,多数患者血浆中卡泊三醇、二丙酸倍氯米松及其代谢物浓度低于或接近定量下限(LOQ),系统暴露量低。
分布:由于系统吸收量低,目前缺乏关于药物在组织中分布的详细数据,推测药物主要在皮肤局部发挥作用,少量吸收后分布于全身循环,但浓度极低。
排泄:说明书中尚未明确药物及其代谢物的具体排泄途径。
贮存方法
需在20℃-25℃的USP控制室温下储存,允许短期波动至15℃-30℃,但需避免长期处于温度过高或过低环境。
药膏开封后,即使仍有剩余,也需在6个月内丢弃,避免微生物污染或药物效价降低。
生产厂家
Almirall Hermal GmbH(赫美药业)