沃拉西德尼是一种口服小分子抑制剂,选择性靶向异柠檬酸脱氢酶1和2(IDH1/IDH2)突变体,用于治疗具有IDH1或IDH2突变的低级别胶质瘤。该药通过抑制2-羟基戊二酸(2-HG)的生成,恢复细胞分化状态,延缓肿瘤进展。
药品称呼
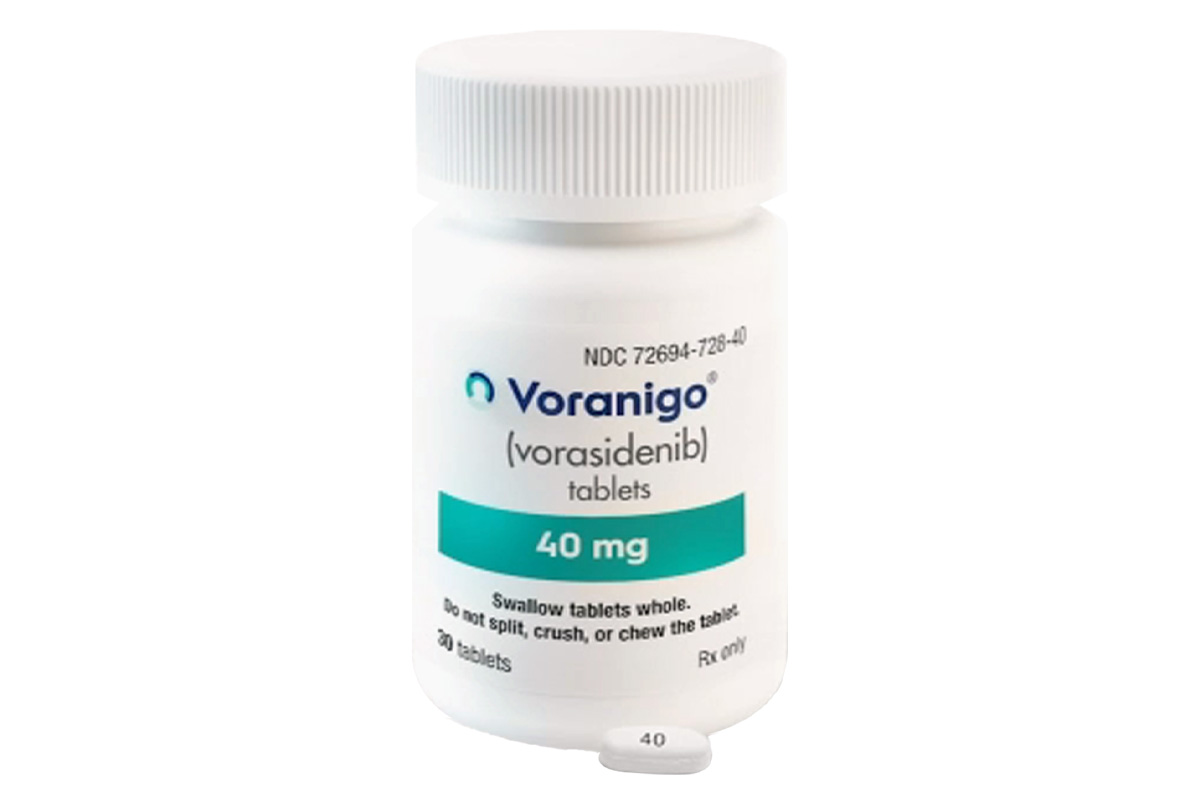
通用名称:沃拉西德尼、Vorasidenib
商品名称:Voranigo
适应靶点
IDH1突变体(包括R132H、R132C、R132G、R132L、R132S)
IDH2突变体(包括R172K、R172G)
适应症和适应人群
适应症:适用于经手术(包括活检、次全切除或全切除)后确诊的、具有IDH1或IDH2突变的2级星形细胞瘤或少突胶质细胞瘤。
适应人群:成人和12岁及以上儿科患者。
规格与性状
规格:40mg*30片/盒。
性状:40mg片剂为白色至类白色椭圆形薄膜衣片,一面印有黑色“40”字样,另一面光滑。
主要成分
活性成分:沃拉西德尼(vorasidenib)。
辅料:交联羧甲基纤维素钠、硬脂酸镁、微晶纤维素、硅化微晶纤维素、十二烷基硫酸钠。
包衣材料:羟丙甲纤维素、一水乳糖、聚乙二醇、二氧化钛。
印刷油墨:氧化铁黑、羟丙甲纤维素、丙二醇。
用法用量
1.开始治疗前推荐评估
开始治疗前应评估血生化及肝功能实验室指标。
2.患者选择
应根据肿瘤样本中IDH1或IDH2突变的存在选择患者。
3.推荐剂量与给药方法
成人:40mg口服,每日一次。
12岁及以上儿科患者:
≥40kg:40mg口服,每日一次。
<40kg:20mg口服,每日一次。
可与食物同服或空腹服用,整片吞服,不可掰开、压碎或咀嚼。
若漏服时间在6小时内,应尽快补服;超过6小时则跳过该次剂量,按原计划时间服用下一次。
服药后若呕吐,无需补服,按原计划时间服用下一次剂量。
4.不良反应的剂量调整与管理
首次剂量降低:
≥40kg患者:20mg每日一次。
<40kg患者:10mg每日一次。
第二次剂量降低:
≥40kg患者:10mg每日一次。
若无法耐受10mg每日一次,永久停药。
肝功能异常管理:
Grade1(ALT/AST>ULN至3×ULN):继续当前剂量,每周监测至恢复。
Grade2(>3至5×ULN):首次发生暂停用药至恢复,28天内恢复可原剂量继续,超过28天则减量;复发则减量继续。
Grade3(>5至20×ULN):首次发生暂停用药,28天内恢复可减量继续,否则永久停药;复发则永久停药。
Grade4(>20×ULN)或伴有胆红素升高:永久停药。
具体您可以阅读沃拉西德尼完整用法用量信息,建议在医生的指导下正确用药。推荐文章:沃拉西德尼的用法用量。
不良反应
常见不良反应(≥15%):疲劳、头痛、COVID-19、肌肉骨骼疼痛、腹泻、恶心、癫痫。
实验室异常(Grade3/4,≥2%):ALT升高、AST升高、GGT升高、中性粒细胞减少。
严重不良反应:肝毒性(包括自身免疫性肝炎、肝衰竭)、癫痫。
具体您可以阅读沃拉西德尼完整副作用信息,建议在医生的指导下正确用药。推荐文章:沃拉西德尼的副作用。
注意事项
1.肝毒性
可能导致转氨酶升高、肝衰竭、肝坏死、自身免疫性肝炎
治疗前及治疗期间应定期监测肝功能(AST、ALT、GGT、总胆红素、碱性磷酸酶)
根据严重程度调整剂量、暂停或永久停药
2.胚胎-胎儿毒性
可能致胎儿危害,育龄期女性需使用有效非激素避孕措施男性患者若有育龄期女性伴侣,也需使用有效避孕措施
特殊人群用药
【孕妇】基于动物数据,可能致胎儿损害。无人类数据。建议告知潜在风险。
【哺乳期女性】无人类乳汁中数据,建议治疗期间及末次剂量后2个月内停止哺乳。
【具有生殖潜力的男性和女性】可能影响生育能力,建议使用有效非激素避孕措施。
【儿童使用】12岁及以上患者安全性和有效性已确立,<12岁患者尚未明确。
【老年人使用】临床研究中≥65岁患者数据有限,无法确定差异。
【肾功能损害】CLcr>40mL/min无需调整剂量;CLcr≤40mL/min或透析患者需密切监测不良反应。
【肝功能损害】轻中度肝功能损害(Child-PughA或B级)无需调整剂量;重度(Child-PughC级)需密切监测。
禁忌症
尚无已知禁忌症。
药物相互作用
1.其他药物对沃拉西德尼的影响
CYP1A2强/中效抑制剂(如氟伏沙明、环丙沙星):可能升高血药浓度,应避免联用。
CYP1A2中效诱导剂(如苯妥英、利福平)及吸烟:可能降低血药浓度,应避免联用。
2.沃拉西德尼对其他药物的影响
CYP3A底物:可能降低其血药浓度,应避免联用。
激素类避孕药:可能降低其疗效,建议使用非激素避孕方法。
药物过量
说明书中尚未明确。
药代动力学
吸收:口服生物利用度34%,高脂餐可显著提高Cmax和AUC。
分布:蛋白结合率97%,脑肿瘤/血浆浓度比为1.6。
代谢:主要经CYP1A2代谢,次要途径包括CYP2B6、2C8、2C9、2C19、2D6、3A。
排泄:85%经粪便排出(56%为原形),4.5%经尿排出。
半衰期:约10天
贮存方法
储存于20°C–25°C(68°F–77°F),允许在15°C–30°C(59°F–86°F)之间短时存放;药瓶内含干燥剂,请勿取出或吞服;使用儿童安全瓶盖。
研发公司
法国Servier(法国施维雅)