卡替拉韦是一种HIV-1整合酶链转移抑制剂(INSTI),通过抑制HIV整合酶的活性,阻断病毒DNA整合到宿主细胞基因组中,抑制HIV-1的复制。
药品称呼
通用名称:卡替拉韦、Cabotegravir
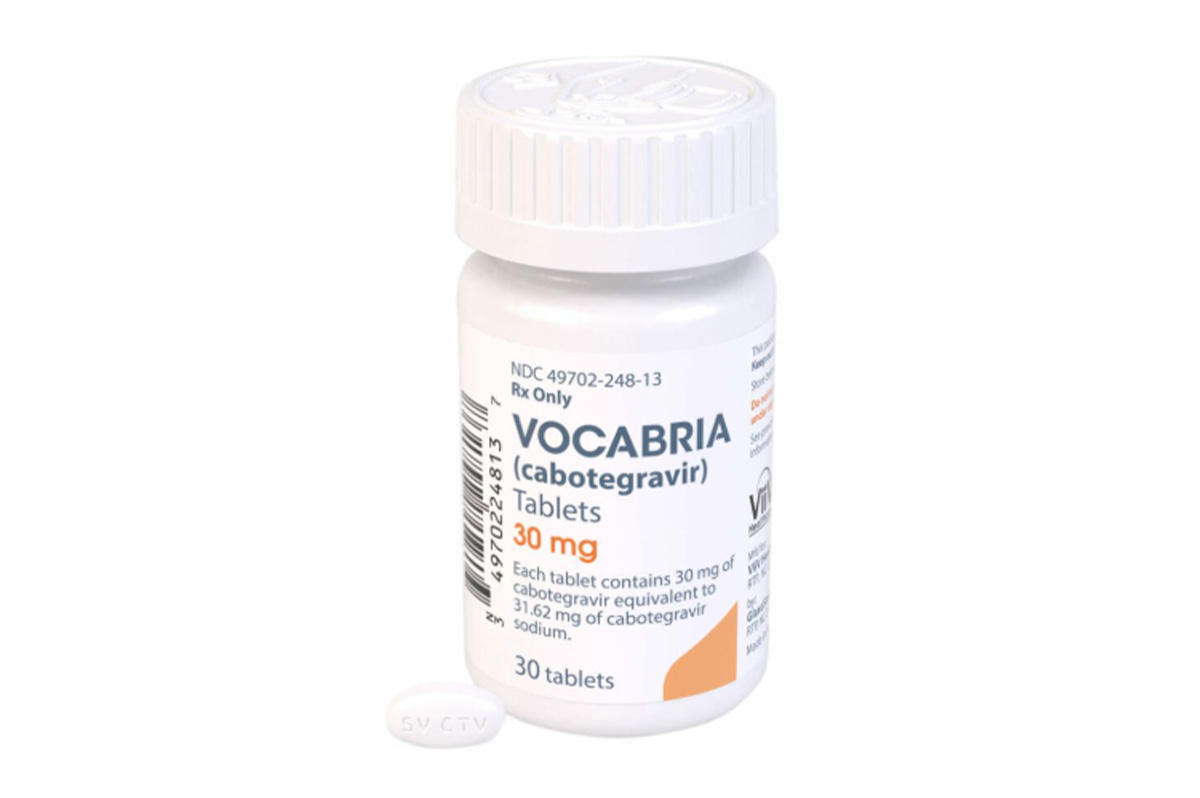
商品名称:Vocabria
适应靶点
HIV-1整合酶
适应症和适应人群
适用于2岁及以上、体重至少35kg的成人和青少年的HIV-1感染治疗,以及体重至少35kg、有HIV-1感染风险的成人和青少年的HIV-1暴露前预防(PrEP)。
规格与性状
规格:片剂,30mg*30片/盒。
性状:白色、椭圆形、双凸面薄膜衣片,一面印有“SVCTV”。主要成分卡替拉韦钠为白色至类白色结晶性粉末,微溶于水。
主要成分
活性成分:卡替拉韦(以卡替拉韦钠形式存在),每片含30mg卡替拉韦(相当于31.62mg卡替拉韦钠)。
辅料:羟丙甲纤维素、乳糖一水合物、硬脂酸镁、微晶纤维素、淀粉羟乙酸钠;薄膜包衣含羟丙甲纤维素、聚乙二醇、二氧化钛。
用法用量
1.HIV-1感染治疗(12岁及以上、体重≥35kg)
口服导入治疗:每日1片30mg卡替拉韦,联合1片25mg利匹韦林(EDURANT),随餐服用,持续约1个月(至少28天)。最后一次口服剂量需与首次CABENUVA注射同日服用。
替代错过的CABENUVA注射:
若患者计划错过每月注射超过7天,需每日服用1片30mg卡替拉韦+1片25mg利匹韦林,随餐服用,最多持续2个月(替代最多2次连续错过的每月注射)。
若患者为每2个月注射方案,计划错过注射超过7天,需每日服用上述剂量,最多持续2个月(替代1次错过的每2个月注射)。
首次口服替代剂量需在最后一次注射后1个月(±7天,每月方案)或2个月(每2个月方案)服用,持续至注射重启当日。若替代超过2个月,需更换其他口服方案。
2.HIV-1暴露前预防(体重≥35kg的成人和青少年)
口服导入治疗:每日1片30mg卡替拉韦,持续约1个月(至少28天)。最后一次口服剂量后3天内需开始APRETUDE注射。
替代错过的APRETUDE注射:若计划错过每2个月注射超过7天,需每日服用1片30mg卡替拉韦,首次剂量在最后一次注射后约2个月服用,持续至注射重启当日(最多3天内)。
HIV筛查要求:启动PrEP前及使用APRETUDE期间,需至少每3个月筛查一次HIV-1。
具体您可以阅读卡替拉韦完整用法用量信息,建议在医生的指导下正确用药。推荐文章:卡替拉韦的用法用量。
不良反应
1.常见不良反应
HIV-1治疗期间(发生率≥3%):疲劳、头痛、腹泻、恶心、头晕、异常梦境、焦虑、失眠、腹部不适、腹胀、乏力。
HIV-1PrEP期间(发生率≥1%):头痛、腹泻、恶心、头晕、上呼吸道感染、嗜睡、疲劳、异常梦境、腹痛。
2.严重不良反应
超敏反应:包括Stevens-Johnson综合征(SJS)、中毒性表皮坏死松解症(TEN),表现为严重皮疹、发热、乏力、肌痛、水疱、黏膜受累(口腔水疱)、结膜炎、面部水肿、呼吸困难等,需立即停药并监测肝功能。
肝毒性:可能出现转氨酶升高,治疗期间需监测肝功能,PrEP期间需考虑临床和实验室监测,疑似肝毒性时停药。
抑郁障碍:包括抑郁情绪、自杀意念/企图,出现症状时需及时评估,权衡继续治疗的风险与获益。
卡替拉韦的副作用具有多样性,建议您阅读卡替拉韦完整副作用信息,推荐文章:卡替拉韦的副作用。
注意事项
1.HIV-1PrEP的综合预防策略
需结合依从性管理、安全性行为(如使用避孕套)等,以降低性传播感染风险。该药并非100%有效,且起效时间未知。
2.超敏反应监测
口服导入期需警惕超敏反应,出现疑似症状(如严重皮疹伴发热、水疱)时立即停药,监测肝功能并给予对症治疗。
3.肝毒性监测
治疗期间定期监测肝功能,基础肝病患者风险更高;PrEP期间需考虑监测,疑似肝毒性时停药。
4.抑郁障碍评估
出现抑郁症状(如情绪低落、自杀想法)时及时评估,必要时调整治疗方案。
5.药物相互作用风险
需警惕与UGT1A1诱导剂的合用,可能降低卡替拉韦浓度,导致疗效丧失或耐药性产生。
6.联合治疗注意事项
与利匹韦林(EDURANT)合用时,需参考利匹韦林说明书,关注其禁忌症和不良反应。
特殊人群用药
【孕妇】人类数据不足,动物研究显示高剂量可能增加死胎和新生儿死亡风险,需权衡获益与风险。
【哺乳期女性】卡替拉韦可能进入乳汁,HIV-1阳性母亲哺乳可能导致婴儿感染或病毒耐药;HIV-1阴性母亲哺乳需评估风险(如药物暴露、HIV-1acquisition风险),疑似急性HIV-1感染时禁止哺乳。
【具有生殖潜力的男性和女性】说明书中尚未明确。
【儿童使用】12岁及以上、体重≥35kg的青少年:安全性和有效性与成人一致,无需调整剂量。12岁以下或体重<35kg:尚未确立安全性和有效性。
【老年人使用】临床数据不足,因可能存在肝、肾、心功能下降或合并疾病,需谨慎用药。
【肾功能损害】轻、中、重度肾损伤(肌酐清除率15-89mL/min):无需调整剂量。终末期肾病(肌酐清除率<15mL/min):药代动力学未知,因药物蛋白结合率>99%,透析可能无法清除。
【肝功能损害】轻、中度肝损伤(Child-PughA或B):无需调整剂量。重度肝损伤(Child-PughC):药代动力学未知,需谨慎。
禁忌症
对卡替拉韦过敏者。
与以下药物合用(可能降低卡替拉韦浓度):卡马西平、奥卡西平、苯巴比妥、苯妥英、利福平、利福喷丁。
HIV-1PrEP时,HIV-1检测阳性或状态未知者(因单药无法治疗HIV-1,可能导致耐药)。
药物相互作用
1.与其他抗逆转录病毒药物
与利匹韦林联合为完整治疗方案,不建议与其他抗逆转录病毒药物合用(PrEP时)。
2.其他药物对卡替拉韦的影响
UGT1A1诱导剂(如利福平):显著降低卡替拉韦浓度,禁止合用。
含多价阳离子的抗酸剂(如铝/镁hydroxide、碳酸钙):需间隔服用(抗酸剂在卡替拉韦前2小时或后4小时),避免吸收减少。
利福布汀:与CABENUVA合用时禁忌,与APRETUDE(PrEP)合用时需调整剂量,与卡替拉韦片剂合用无需调整。
3.无显著相互作用的药物
包括依曲韦林、咪达唑仑、含左炔诺孕酮和乙炔雌二醇的口服避孕药、利福布汀、利匹韦林等,合用无需调整剂量。
药物过量
无特异性解毒剂,过量时需监测患者状态,给予支持治疗(如对症处理)。因药物蛋白结合率高,透析无法有效清除。
药代动力学
吸收:口服后达峰时间(Tmax)中位数为3小时,高脂餐对吸收影响较小(AUC增加14%)。
分布:血浆蛋白结合率>99.8%,血-浆比0.52,脑脊液-血浆比中位数0.003。
代谢:主要经UGT1A1代谢,UGT1A9有少量参与。
消除:半衰期约41小时,主要经代谢清除,尿液和粪便中分别排泄27%和59%(以放射性标记物计,原形药物极少)。
特殊人群:青少年(≥35kg)与成人暴露量相似;性别、种族、BMI对药代动力学无显著影响。
贮存方法
储存于30°C(86°F)以下环境,置于儿童不可触及处。
研发公司
ViiV Healthcare