司替戊醇是一种专门用于治疗癫痫的药物,主要通过双重作用机制发挥疗效。首先,它通过直接作用于γ-氨基丁酸(GABA)A受体,增强大脑的抑制性神经传导,从而减轻神经元的异常放电;其次,它通过抑制细胞色素P450酶(CYP3A4和CYP2C19)的代谢活性,增加联用药物氯巴占及其活性代谢物在血液中的浓度,从而更好地协同控制癫痫发作。
药品名称
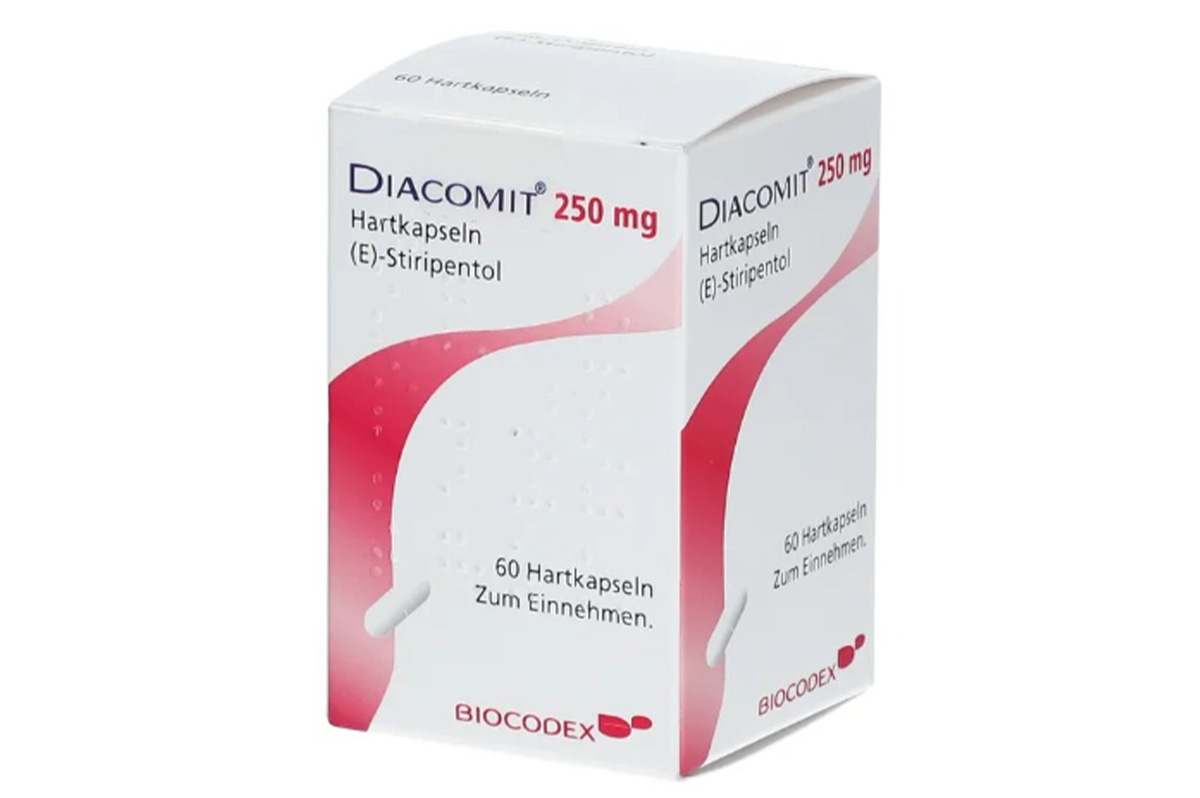
通用名称:司替戊醇、Stiripentol
商品名称:Diacomit
作用机制与靶点
GABA受体:通过增强GABA神经递质的作用,抑制大脑异常电活动。
CYP450酶系统(CYP3A4、CYP2C19):抑制代谢酶活性,增加氯巴占及其代谢产物的药物浓度,增强其治疗效果。
适应症与适应人群
适应症:本药适用于Dravet综合征相关的难治性癫痫发作,需与氯巴占联用治疗,不能单独使用。
适应人群:适用于6个月及以上、体重大于等于7公斤的患者。
使用限制:本药尚无单药治疗的临床数据;不适用于6个月以下或体重小于7公斤的儿童。
规格与性状
规格:250mg*60粒/盒;
性状:粉色胶囊剂,标有“Diacomit”和“250mg”字样。
主要成分
活性成分:司替戊醇
用法用量
1、推荐剂量
根据体重调整剂量,每天50mg/kg,分2-3次口服,随餐服用(最大日剂量不超过3000mg)。
不同年龄段的剂量:
6个月至1岁:25mg/kg,每日两次。
≥1岁且体重≥10kg:25mg/kg每日两次或16.67mg/kg每日三次。
2、给药方式
请整粒吞服,不可咀嚼或掰开。
3、漏服处理
如果接近下一次服药时间,请跳过漏服的剂量,切勿一次服用双倍剂量。
4、停药指导
停药应逐步减量,避免出现癫痫发作反弹或持续状态。
建议您阅读司替戊醇用药指南完整信息,并在医生的指导下用药。推荐文章:司替戊醇(stiripentol)的用法用量。
不良反应
常见不良反应(发生率≥10%)
嗜睡、食欲减退、体重减轻、共济失调、激越、肌张力减退、震颤、构音障碍、失眠。
严重不良反应
中性粒细胞减少、血小板减少、自杀倾向(需密切监测患者的情绪和行为变化)。
注意事项
嗜睡风险:与氯巴占或其他中枢神经系统抑制剂联合使用时,应定期监测,必要时可减少氯巴占剂量25%。
体重监测:定期评估儿童的生长发育情况,如果出现显著的食欲减退,可以考虑减少丙戊酸的使用剂量。
血液监测:治疗前及每6个月检查中性粒细胞和血小板的计数。
苯丙酮尿症:混悬液含有阿斯巴甜(苯丙氨酸),因此苯丙酮尿症患者需要谨慎使用。
自残倾向:所有抗癫痫药物可能增加自残倾向,因此在治疗期间应密切监测患者的情绪和行为变化。
停药风险:突然停药可能会引发癫痫持续状态,需逐步减量。
特殊人群用药
【孕妇】尚无足够数据说明司替戊醇在孕妇中的发育风险。动物实验显示,孕期给予司替戊醇可导致胎儿畸形发生率增加、胚胎-胎儿和幼崽死亡率升高、生长减慢,且产生影响的母体剂量低于推荐临床剂量。建议患者如怀孕或计划怀孕,需告知医护人员,权衡治疗需求与潜在风险。
【哺乳期女性】尚无司替戊醇在人乳中存在的数据,也不明确其对母乳喂养婴儿或乳汁产生的影响。应综合考虑母乳喂养的发育和健康益处、母亲对司替戊醇的临床需求以及药物对婴儿的潜在不良影响后做出决策。
【具有生殖潜力的男性和女性】说明书中尚未明确。
【儿童使用】司替戊醇在6个月及以上、体重7kg及以上且服用氯巴占的Dravet综合征患儿中的安全性和有效性已确立。在6个月以下或体重低于7kg的儿科患者中,其安全性和有效性尚未确立。
【老年人使用】Dravet综合征的临床研究未纳入65岁及以上患者,无法确定其与年轻患者的反应是否不同。使用时应考虑老年患者可能存在的肝肾功能异常。
【肾功能损害】尚无司替戊醇在肾功能损害患者中的药代动力学和代谢的正式研究。由于司替戊醇代谢物主要经肾脏排泄,不建议中重度肾功能损害患者使用。
【肝功能损害】尚无司替戊醇在肝功能损害患者中的药代动力学正式研究。由于药物主要经肝脏代谢,不建议中重度肝功能损害患者使用。
禁忌症
目前尚无明确的禁忌症。
药物相互作用
1.司替戊醇对其他药物的影响
CYP1A2、CYP2B6、CYP3A4、CYP2C8、CYP2C19、P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)底物:体外数据显示,司替戊醇既是CYP1A2、CYP2B6、CYP3A4的抑制剂也是诱导剂。由于可能存在药物相互作用,与 CYP1A2 底物(如茶碱、咖啡因)、CYP2B6 底物(如舍曲林、噻替哌)、CYP3A4 底物(如咪达唑仑、三唑仑、奎尼丁)联用时,应根据临床情况考虑调整剂量。
由于司替戊醇可能抑制CYP2C8、CYP2C19及药物转运体(P-gp、BCRP)的活性,与这些酶或转运体的底物(如CYP2C19底物地西泮、氯吡格雷;P-gp底物卡马西平;BCRP底物甲氨蝶呤、哌唑嗪、格列本脲)联用时,若出现不良反应,应考虑减少底物剂量。
氯巴占:司替戊醇(抑制 CYP3A4 和 CYP2C19)与氯巴占联用会使氯巴占(CYP3A4 底物)及其活性代谢物去甲氯巴占(CYP2C19底物)的血浆浓度升高,可能增加氯巴占相关不良反应风险。联用时若出现不良反应,应考虑减少氯巴占剂量。
2.其他药物对司替戊醇的影响
司替戊醇可被CYP1A2、CYP3A4、CYP2C19代谢,与强效诱导剂(如利福平、苯妥英、苯巴比妥、卡马西平)联用时,可能因诱导作用降低司替戊醇浓度。应避免联用强效诱导剂,或根据情况调整剂量。
3.中枢神经系统抑制剂和酒精
司替戊醇与其他中枢神经系统抑制剂(包括酒精)联用可能增加镇静和嗜睡风险。
药物过量
动物实验表明,过量使用可能导致运动抑制及呼吸减缓。需进行对症治疗,并及时联系毒物控制中心。
药代动力学
吸收:司替戊醇的血药浓度在服用后的2-3小时内达到峰值,且随着剂量的增加,药物的暴露量呈非线性上升。
分布:药物在体内与血浆蛋白结合率高达99%。
代谢:主要通过CYP1A2、2C19、3A4代谢。
消除:半衰期为4.5至23.5小时,儿童患者的半衰期较长。
贮存条件
20-25℃存储,保持干燥,避光保存。原包装存放,混悬液粉末开封后应尽快使用。
生产厂家
法国Biocodex(法国百科达制药厂)