



在CONFIRM中比较了氟维司群(芙仕得)500毫克与250毫克的疗效。
在研究0020和0021中比较了氟维司群(芙仕得)250毫克与1毫克阿那曲唑的疗效。
在FALCON中比较了500毫克氟维司群(芙仕得)与1毫克阿那曲唑的疗效。
在PALOMA-3中比较了氟维司群(芙仕得) 500毫克联合哌柏西利125毫克与氟维司群(芙仕得)500毫克加安慰剂的疗效。
在MONARCH-2中比较了氟维司群(芙仕得) 500毫克联合阿贝西利150毫克与氟维司群(芙仕得) 500毫克加安慰剂的疗效。
在MONALEESA-3中比较了氟维司群(芙仕得) 500毫克联合瑞波西利600毫克与氟维司群(芙仕得) 500毫克加安慰剂的疗效。
1、单一疗法
1)氟维司群(芙仕得) 500毫克与250毫克的比较(确认)
一项随机、双盲、对照临床试验(CONFIRM,NCT00099437)在736例绝经后晚期乳腺癌患者中完成,这些患者在辅助内分泌治疗之日或之后出现疾病复发,或在晚期疾病内分泌治疗之后出现进展。本试验比较了氟维司群(芙仕得) 500毫克(n=362)与250毫克(n=374)的疗效和安全性。
氟维司群(芙仕得) 500毫克以两支5毫升注射液的形式给药,每支含有氟维司群(芙仕得) 250毫克/5毫升,在第1、15、29天和之后的每28天(+/- 3),每边臀部各注射一支。 氟维司群(芙仕得)250毫克以两支5毫升注射液(一支含 氟维司群(芙仕得)250毫克/5毫升注射液,另一支含安慰剂注射液)的形式给药,每边臀部各注射一支,注射时间为第 1、15(仅注射两支安慰剂)、29 天,此后每28(+/- 3)天注射一次。
研究参与者的中位年龄为61岁。所有患者均为ER+晚期乳腺癌。大约30%的受试者没有可测量的疾病。大约55%的患者患有内脏疾病。
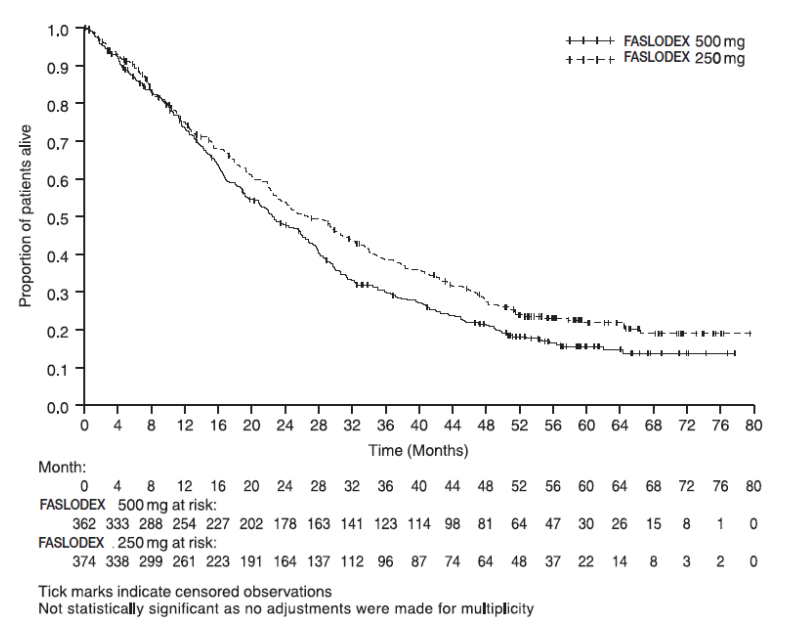
确认结果汇总见下表。将500毫克与250毫克的疗效进行比较。下图显示了最少随访18个月后无进展生存(PFS)数据的Kaplan-Meier图,显示500毫克具有统计学意义的优势。氟维司群(芙仕得)250毫克。在最短随访时间为18个月后的初始总生存期(OS)分析中,两组治疗组之间的OS差异无统计学意义。在至少随访50个月后,进行了更新的OS分析。下图显示了更新后的OS数据的Kaplan-Meier图。
表:确认[意向治疗(ITT)人群]的疗效结果
![确认[意向治疗(ITT)人群]的疗效结果 确认[意向治疗(ITT)人群]的疗效结果](/profile/upload/FASLODEX1.png)
1 PFS(无进展生存期)=从随机化到任何原因导致的最早进展或死亡之间的时间。至少随访时间为18个月。
2 危险比<1有利于氟维司群(芙仕得) 500毫克。
3 CI =置信区间
4 OS =总生存期
5 最小随访时间为50个月。
6 不具有统计学意义,因为未对多样性进行调整。
7 ORR(客观缓解率),定义为在基线时可评估的可测量疾病患者中出现完全缓解或部分缓解的患者人数(%),进行分析(氟维司群(芙仕得)500毫克,N = 240;氟维司群(芙仕得)250毫克,N=261)。最小随访时间为18个月。
图:Kaplan-Meier PFS:确认ITT人口
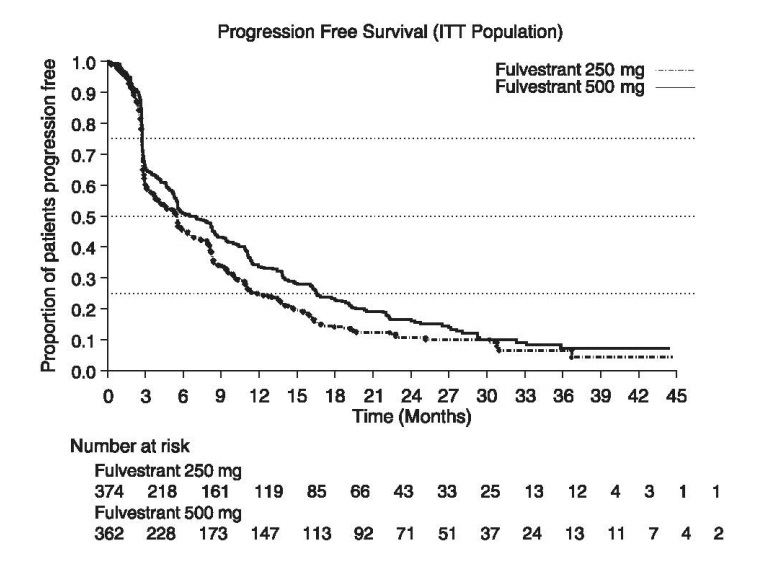
图:Kaplan-Meier OS(最小随访时间为50个月):确认ITT人口
2)氟维司群(芙仕得) 500毫克与阿那托唑1毫克(FALCON)的比较
在ER阳性和/或PgR阳性、HER2阴性局部晚期或转移性乳腺癌且之前未接受过任何激素治疗的绝经后妇女中,进行了一项氟维司群(芙仕得)500毫克与阿那托唑1毫克比较的随机、双盲、双模拟、多中心研究(FALCON,NCT01602380)。共有462名患者按1:1的比例随机接受氟维司群(芙仕得)500毫克肌肉注射给药(第1、15、29天,此后每28 (+/3)天一次)或每日口服1 毫克阿那托唑。本研究比较了氟维司群(芙仕得)500毫克和阿那托唑1毫克的疗效和安全性。
根据疾病设置(局部晚期或转移性)、既往使用晚期疾病化疗以及是否存在可测量的疾病进行随机分层。
该研究的主要疗效结果衡量指标是根据RECIST v.1.1(实体肿瘤反应评估标准)评估研究者评估的无进展生存期(PFS)。关键的次要疗效结果指标包括总生存期(OS)、客观缓解率(ORR)和反应持续时间(DoR)。
纳入本研究的患者的中位年龄为63岁(范围为36-90岁)。大多数患者(87%)在基线时有转移性疾病。55%(55%)的患者在基线时有内脏转移。共有17%的患者曾接受过一种晚期疾病的化疗方案;84%的患者有可测量的疾病。转移部位如下:肌肉骨骼转移59%,淋巴结转移50%,呼吸转移40%,肝脏(包括胆囊转移)18%。
下表和下图所示为FALCON的疗效结果。
表:FALCON的疗效结果(研究者评估,ITT人群)
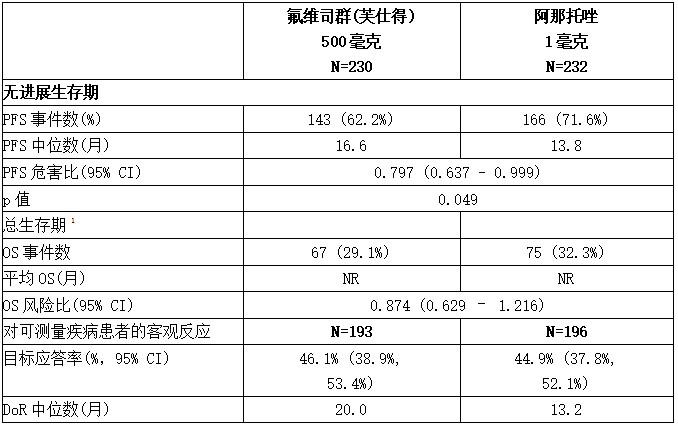
NR:未达到
1 中期OS分析,占最终OS分析所需事件总数的61%。
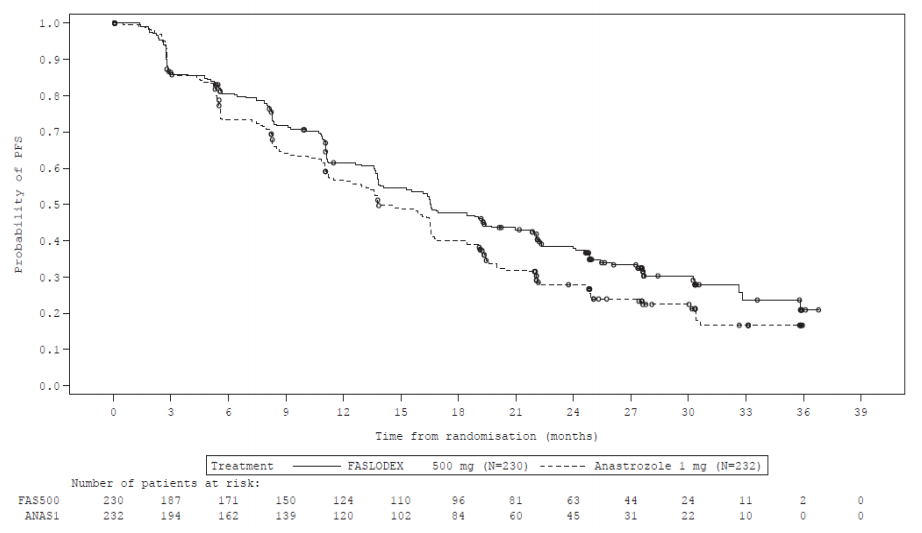
图:无进展生存期的Kaplan-Meier图(研究者评估,ITT人群)-FALCON
3)氟维司群(芙仕得) 250毫克与阿那托唑1毫克的综合数据比较(0020和0021号研究)
在两项随机、对照临床试验中,通过与选择性芳香酶抑制剂阿那托唑进行比较,确定了氟维司群(芙仕得)的疗效(其中一项研究在北美进行,名为 "0021 研究",NCT00635713;另一项研究主要在欧洲进行,名为 "0020 研究"。)在患有局部晚期或转移性乳腺癌的绝经后妇女中进行。在辅助治疗或晚期疾病背景下,所有患者在先前接受抗雌激素或孕激素治疗乳腺癌后均有进展。
研究参与者的中位年龄为64岁。81.6%的患者有ER+和/或PgR+肿瘤。ER-/PgR-或未知肿瘤患者需证明对内分泌治疗有既往反应。转移部位如下:内脏仅18.2%;脏腑-肝受累23.0%;肺部受累28.1%;骨仅19.7%;软组织仅5.2%;皮肤及软组织18.7%。
在这两项试验中,符合条件的可测量和/或可评估疾病的患者随机接受法司托250毫克肌肉注射,每月1次(28天+3天)或阿那曲唑1毫克口服,每日1次。所有患者在前三个月每月进行评估一次,之后每三个月进行评估一次。研究0021是一项双盲随机试验,对象400名绝经后妇女。研究0020是一项开放标签的随机试验,在451名绝经后妇女中进行。研究0021中的法膜胺组患者接受了两次单独注射(2×2.5毫升),而研究0020中的法膜胺组患者接受了单次注射(1×5毫升)。在这两项试验中,患者最初也被随机分配到每月125 毫克的剂量,但中期分析显示反应率非常低,低剂量组被放弃。
至少随访14.6个月后的试验结果汇总见下表。通过比较客观反应率(ORR)和进展时间(TTP)与阿那托唑1毫克的主动对照结果,确定阿那托唑250毫克的有效性。这两项研究排除了(以单侧97.7%的置信限)对阿那托唑的ORR分别为6.3%和1.4%。在0021随访28.2个月和0020随访24.4个月后,两个治疗组之间的总生存期(OS)无统计学差异。
表:研究0020和0021的疗效结果[客观有效率(ORR)和进展时间(TTP)]
![研究0020和0021的疗效结果[客观有效率(ORR)和进展时间(TTP)] 研究0020和0021的疗效结果[客观有效率(ORR)和进展时间(TTP)]](/profile/upload/FASLODEX6.png)
1 CR =完全响应
2 PR =部分响应
3 FAS=氟维司群(芙仕得)
4 ANA =阿那托唑
5 CI =置信区间
6 危险比<1有利于氟维司群(芙仕得)
2、联合治疗
1)HR阳性、HER2阴性晚期或转移性乳腺癌患者,在先前的辅助或转移性内分泌治疗之日或之后出现疾病进展
a.氟维司群(芙仕得)500毫克联合哌柏西利125毫克(PALOMA-3)
PALOMA-3 (NCT-1942135)是一项国际、随机、双盲、平行组、多中心研究,对患有HR阳性、HER2阴性晚期乳腺癌的女性(无论其绝经状态如何,其疾病在既往内分泌治疗当日或之后进展)进行氟维司群(芙仕得)+哌柏西利与氟维司群(芙仕得)+安慰剂比较。
共有521名绝经前/绝经后妇女按2:1随机分配到 氟维司群(芙仕得) 加哌柏西利或氟维司群(芙仕得)加安慰剂的治疗方案中,并根据记录的对先前激素治疗的敏感性、研究开始时的绝经状态(绝经前/绝经前与绝经后)以及是否存在内脏转移灶进行分层。 哌柏西利的口服剂量为每天125毫克,连续服用21天,然后停药7天。氟维司群(芙仕得)500毫克以两支5毫升注射剂的形式给药,每支含氟维司群(芙仕得)250毫克/5毫升,第1、15、29天和之后每28(+/- 3)天每边臀部各注射一支。 绝经前/绝经妇女参加了这项研究,并在PALOMA-3研究之前和研究期间至少4周接受了LHRH激动剂戈舍瑞林的治疗。
患者继续接受指定治疗,直至出现客观疾病进展、症状恶化、不可接受的毒性、死亡或撤销同意(以先发生者为准)。本研究的主要疗效结果由研究者评估,PFS根据RECIST v.1.1进行评估。
纳入本研究的患者中位年龄为57岁(范围为29至88岁)。研究中的大多数患者为白人(74%),所有患者的ECOG PS为0或1,80%为绝经后。所有患者均曾接受过全身治疗,75%的患者均曾接受过化疗方案。25%的患者在转移性疾病环境中之前没有接受过任何治疗,60%有内脏转移,23%只有骨性疾病。
下表汇总了研究者评估的PFS结果和PALOMA-3的最终OS数据。图9和图10分别显示了相关的Kaplan-Meier图。在不同疾病部位、既往激素治疗敏感性和绝经状态的患者分组中观察到一致的PFS结果。中位随访时间为45个月后,最终OS结果无统计学意义。
表:PALOMA-3的疗效结果(研究者评估,ITT人群)
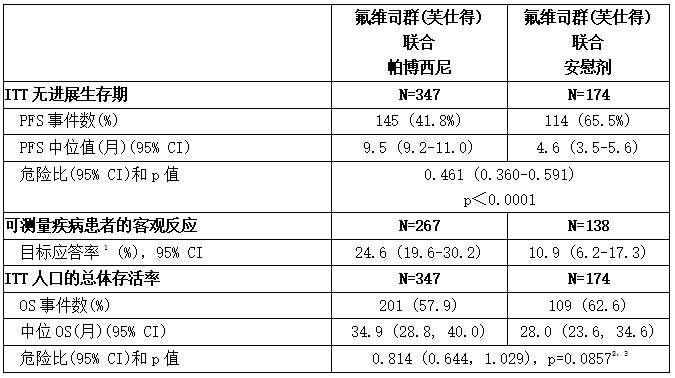
n =患者人数;PFS =无进展生存期;CI =置信区间;ITT =意向治疗;OS =总生存期。
1 答复是基于已确认的答复。
2 在预先确定的双侧α水平0.047时无统计学意义。
3 根据内脏转移的存在和每次随机分配对既往内分泌治疗的敏感性分层的对数秩检验的双侧p值。
图:无进展生存期的Kaplan-Meier图(研究者评估,ITT人群)-PALOMA-3
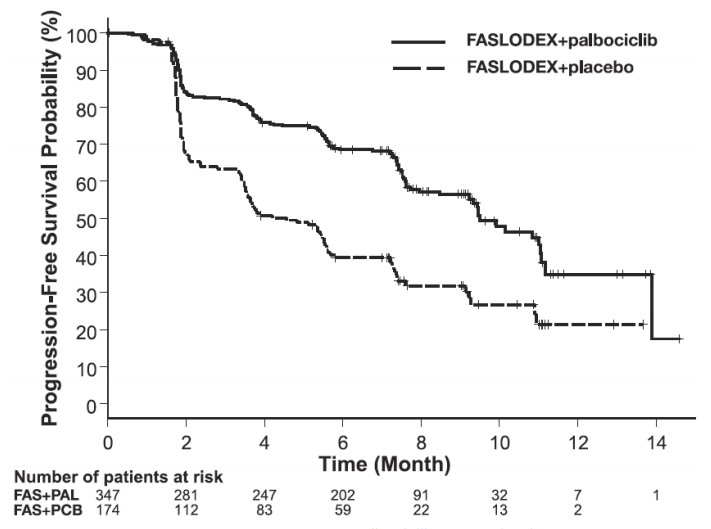
FAS=氟维司群(芙仕得); PAL=哌柏西利; PCB=安慰剂。
图:总生存率(ITT人群)的Kaplan-Meier图-PALOMA-3
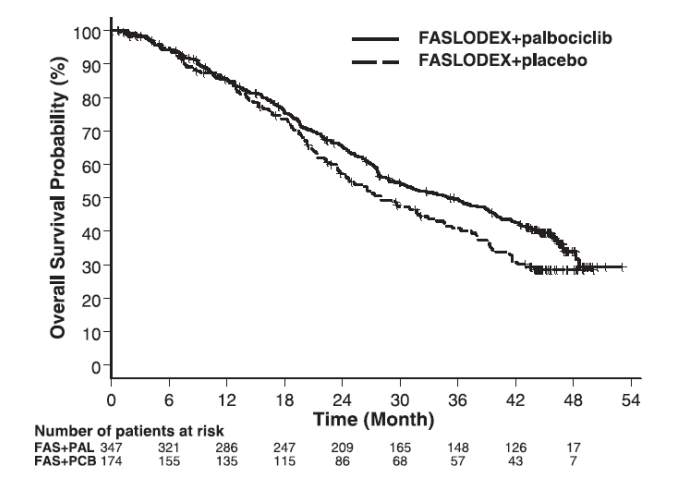
FAS=氟维司群(芙仕得);PAL=哌柏西利;PCB=安慰剂
b.氟维司群(芙仕得) 500 毫克联合阿贝西利150 毫克(MONARCH 2)
MONARCH 2(NCT 02107703)是一项随机、安慰剂对照、多中心研究,在接受氟维司群(芙仕得)+阿贝西利内分泌治疗的HR阳性、HER2阴性转移性乳腺癌女性患者中进行,与氟维司群(芙仕得)+安慰剂治疗的患者进行比较。
随机分配按疾病部位(仅内脏、骨或其他)和对既往内分泌治疗的敏感性(原发性或继发性耐药性)分层。共有669名患者在第1周期的第1和第15天,然后在第2周期的第1天及以后(28天周期),接受了500毫克氟维司群(芙仕得)肌肉注射,外加每日两次的阿贝西利或安慰剂口服给药。绝经前/围绝经期妇女被纳入本研究,在MONARCH 2之前和期间接受促性腺激素释放激素激动剂戈舍瑞林治疗至少4周。患者继续接受持续治疗,直至出现进行性疾病或不可控制的毒性。
患者中位年龄为60岁(范围为32-91岁),37%的患者年龄超过65岁。多数患者为白人(56%),99%的患者东部肿瘤协作组(ECOG)绩效状态为0或1。20%的患者(20%)患有新发转移性疾病,27%的患者患有纯骨疾病,56%的患者患有内脏疾病。百分之二十五(25%)的患者存在原发性内分泌治疗耐药性。17%的患者处于绝经前或围绝经期。
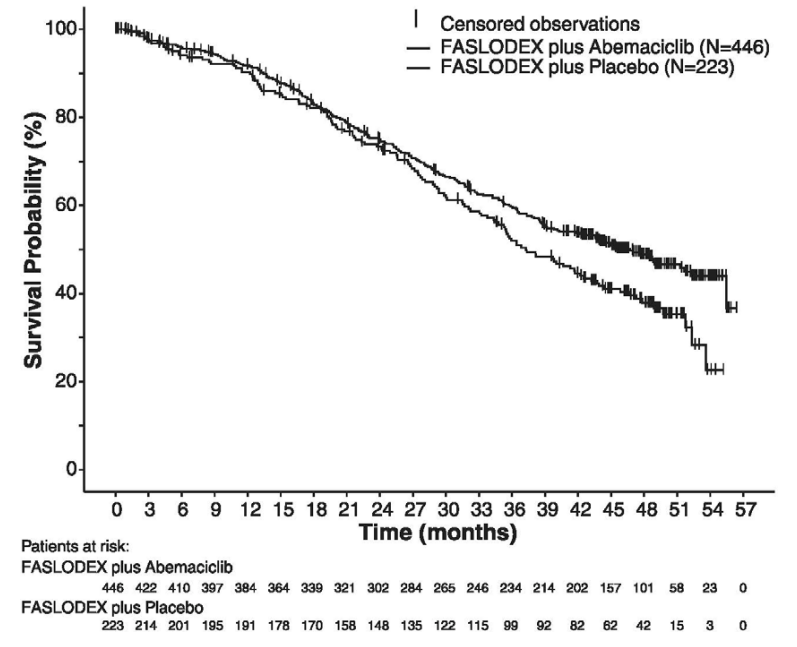
下表和下图汇总了MONARCH 2研究的疗效结果。基于盲法独立放射学审查的PFS评估与研究者评估一致。在患者分层分组(疾病部位和内分泌治疗耐药性)中观察到的PFS和OS结果一致。
表:MONARCH 2的疗效结果(意向治疗人群)
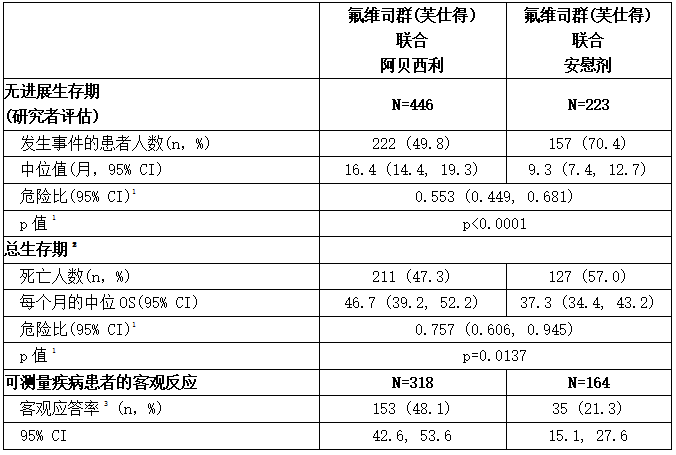
缩写:CI =置信区间,OS =总生存期。
1 按疾病部位分层(内脏转移与纯骨转移对比其他)和内分泌治疗耐药性(原发性耐药性与继发性耐药性)
2 来自事先确定的互分析(计划最终分析所需事件数的77%)的数据,p值与分配的α值比较为0.021。
3 完全应答+部分应答。
图:无进展生存期的Kaplan-Meier曲线:氟维司群(芙仕得)+阿贝西利相对于氟维司群(芙仕得)+安慰剂(MONARCH 2)
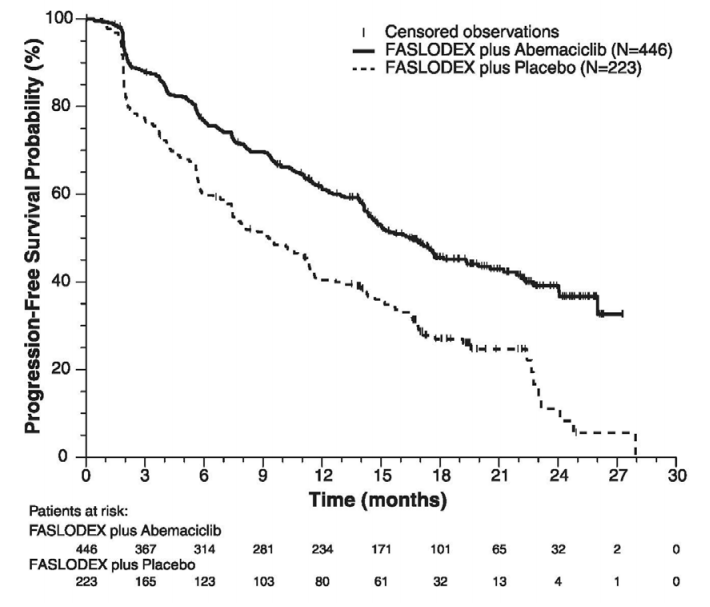
图:总生存期的Kaplan-Meier曲线:氟维司群(芙仕得)+阿贝西利相对于氟维司群(芙仕得)+安慰剂(MONARCH 2)
HR阳性、HER2阴性晚期或转移性乳腺癌的绝经后妇女,接受初始内分泌治疗或内分泌治疗后疾病进展
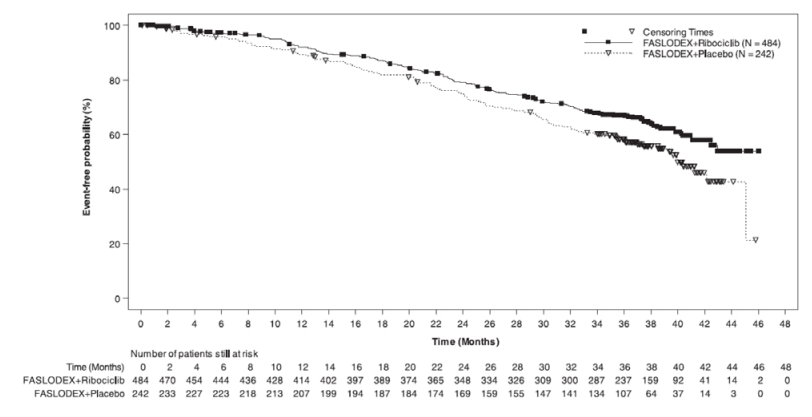
c.氟维司群(芙仕得) 500毫克联合瑞博西尼600毫克(MONALEESA-3)
MONALEESA-3(NCT 02422615)是一项随机、双盲、安慰剂对照研究,比较氟维司群(芙仕得)+瑞博西尼与氟维司群(芙仕得)+安慰剂,研究对象为激素受体阳性、HER2阴性、未接受过或仅接受过一次内分泌治疗的绝经后晚期乳腺癌妇女。
共有726名患者按2:1的比例被随机分配接受氟维司群(芙仕得)+瑞博西尼或氟维司群(芙仕得)+安慰剂治疗,并根据是否存在肝和/或肺转移以及是否接受过晚期或转移性疾病的内分泌治疗进行分层。第1、15、29天肌肉注射氟维司群(芙仕得)500毫克,之后每月一次,随后连续21天每日一次口服给予瑞博西尼600毫克或安慰剂,之后休息7天,直至疾病进展或出现不可接受的毒性。本研究的主要疗效结果衡量指标是研究者使用实体瘤应答评估标准(RECIST) v1.1评估的无进展生存期(PFS)。
纳入本研究的患者中位年龄为63岁(范围为31至89岁)。纳入的患者中,47%为65岁及以上,其中14%为75岁及以上。纳入的患者主要为白人(85%)、亚洲人(9%)和黑人(0.7%)。几乎所有患者(99.7%)的ECOG表现状态均为0或1。本研究纳入了一线和二线患者(其中19%为新发转移性疾病)。在研究进入前,43%(43%)的患者接受过辅助化疗,而新辅助化疗组为13%;59%的患者接受过辅助内分泌治疗,而新辅助化疗组为1%。21%的患者(21%)患有纯骨疾病,61%患有内脏疾病。人口统计学和基线疾病特征在研究组之间是平衡和可比的。
下表和下图汇总了MONALEESA-3的疗效结果。在疾病部位的分层因子亚组和晚期疾病的既往内分泌治疗中观察到了一致的结果。
表:疗效结果-MONALEESA-3(研究者评估,意向治疗人群)
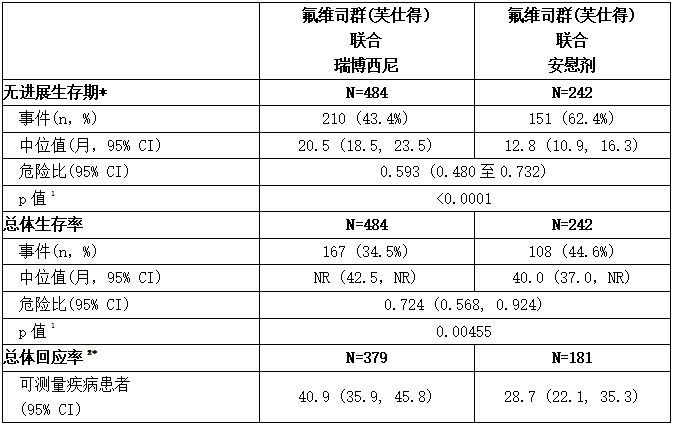
缩写:NR:未达到
1 p值是从单侧对数秩获得的
2 基于已确认的响应
* 研究者评估
图:无进展生存期的Kaplan-Meier曲线-MONALEESA-3(意向治疗人群,研究者评估)
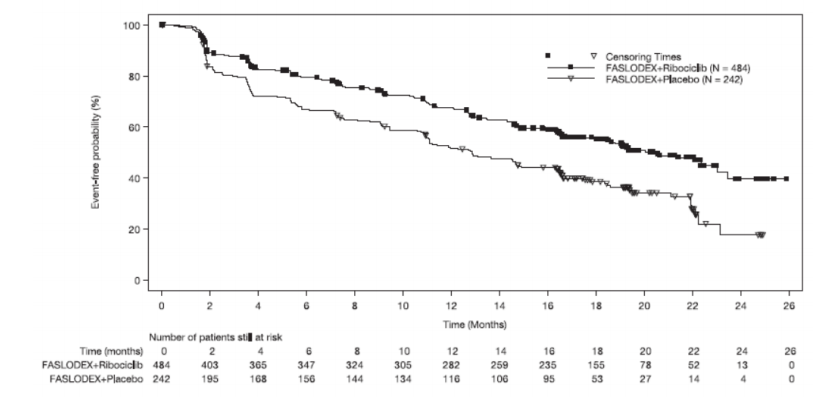
图:总生存期的Kaplan-Meier曲线-MONALEESA-3(意向治疗人群)



互联网药品信息服务资格证书

孟加拉耀品国际授权书

孟加拉珠峰制药授权书

孟加拉伊思达制药授权书

孟加拉伊思达制药授权书

土耳其医院授权书
 正品保障
正品保障
 厂家直采
厂家直采
 专业药师
专业药师
 品类齐全
品类齐全