福巴替尼(Futibatinib)是一种口服小分子激酶抑制剂,通过不可逆结合成纤维细胞生长因子受体(FGFR)1、2、3和4,抑制其磷酸化及下游信号通路,从而阻断肿瘤细胞的增殖与存活。
药品称呼
通用名称:福巴替尼、Futibatinib
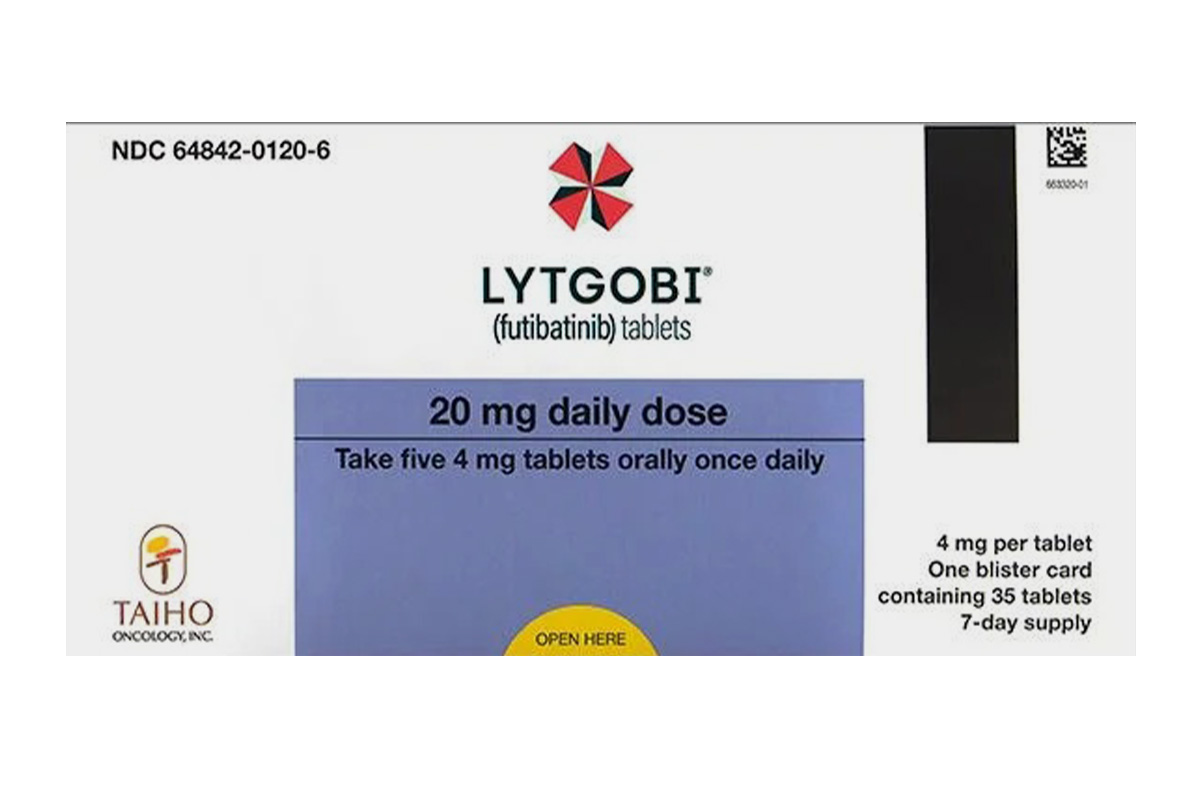
商品名称:Lytgobi
适应靶点
FGFR2基因融合或其他重排:需通过基因检测确认。
适应症和适应人群
适应症
用于治疗既往接受过全身治疗、不可切除的局部晚期或转移性肝内胆管癌成人患者,且肿瘤需存在FGFR2基因融合或重排。
适应人群
经基因检测确认FGFR2异常的成人患者。
不适用人群
儿童及未确认FGFR2异常的患者。
规格与性状
规格
20mg*35片/盒;
性状
圆形白色薄膜衣片剂,一面刻有“4MG”,另一面刻有“FBN”。
主要成分
活性成分:福巴替尼。
用法用量
1、推荐剂量
初始剂量:每次口服20mg(5片4mg),每日一次,随餐或空腹服用。
持续治疗:直至疾病进展或出现不可耐受毒性。
2、剂量调整
首次减量:16mg(4片)每日一次。
二次减量:12mg(3片)每日一次。若仍无法耐受,永久停药。
3、特殊处理
漏服超过12小时或服药后呕吐,跳过该次剂量,按原计划服用下一剂。
整片吞服,不可碾碎、咀嚼或溶解。
具体您可以阅读福巴替尼完整用法用量信息,建议在医生的指导下正确用药。推荐文章:福巴替尼(futibatinib)的用法用量。
不良反应
1、常见不良反应(≥20%)
皮肤及皮下组织
指甲毒性、脱发、皮肤干燥、手足综合征。
胃肠道
便秘、腹泻、口干、口腔炎、腹痛、恶心、呕吐。
全身性症状
乏力、肌肉骨骼痛、关节痛。
实验室异常
高磷血症、肌酐升高、血红蛋白降低、低钠、ALT升高。
2、严重不良反应
眼部毒性、高磷血症。
如果在使用福巴替尼期间出现副作用,应及时咨询医生。建议您阅读福巴替尼副作用完整信息,推荐文章:福巴替尼(futibatinib)的副作用。
注意事项
1、眼部毒性
治疗前及治疗期间每2个月进行眼科检查(包括OCT),出现视力模糊等症状需立即就医。建议使用人工泪液缓解干眼症状。
2、高磷血症
监测血磷水平,若≥5.5mg/dL需启动低磷饮食及降磷治疗,严重时调整剂量或停药。
3、胚胎-胎儿毒性
孕妇禁用,育龄期患者需在治疗期间及停药后1周内采取有效避孕措施。
特殊人群用药
【孕妇】福巴替尼可对胎儿造成伤害,包括胎儿畸形、生长迟缓及胚胎-胎儿死亡。尚无孕妇使用数据,告知孕妇潜在风险,孕期避免使用。
【哺乳期女性】尚无福巴替尼或其代谢物在人乳中存在的数据,以及对母乳喂养婴儿或乳汁产生的影响。由于可能对母乳喂养婴儿造成严重不良反应,建议哺乳期女性在治疗期间及最后一剂后1周不要母乳喂养。
【具有生殖潜力的男性和女性】女性治疗前需核实妊娠状态,治疗期间及最后一剂后1周需使用有效避孕措施。有生殖潜力女性伴侣或伴侣已怀孕的男性,治疗期间及最后一剂后1周需使用有效避孕措施。
【儿童使用】尚未确立福巴替尼在儿科患者中的安全性和有效性。
【老年人使用】在临床研究中,65岁及以上患者与年轻成年患者在安全性和有效性方面未观察到总体差异。
【肾功能损害】轻至中度肾功能损害(肌酐清除率30-89mL/min,按Cockcroft-Gault法估算)患者中,福巴替尼的全身暴露量无临床意义差异。尚未在重度肾功能损害(肌酐清除率15-29mL/min)、终末期肾病透析患者(肌酐清除率<15mL/min)中研究其药代动力学。
【肝功能损害】轻度肝功能损害(总胆红素≤正常上限且天冬氨酸转氨酶>正常上限,或总胆红素>1-1.5×正常上限且任何天冬氨酸转氨酶,或Child-PughA级)或总胆红素<1.5×正常上限的中至重度肝功能损害(Child-PughB至C级)患者中,福巴替尼的全身暴露量无临床意义差异。
肝硬化且总胆红素>1.0-1.5×正常上限的患者,未结合福巴替尼的暴露量增加;肝硬化且总胆红素>1.5×正常上限的患者,未结合福巴替尼暴露量显著增加,此类患者可能面临更高的不良反应风险。
禁忌症
无明确禁忌症。
药物相互作用
其他药物对福巴替尼的影响
福巴替尼是CYP3A和P-糖蛋白(P-gp)的底物。应避免与双重P-gp和强CYP3A抑制剂合用,因合用可能增加福巴替尼暴露量,从而增加不良反应的发生率和严重程度。也应避免与双重P-gp和强CYP3A诱导剂合用,因合用可能降低福巴替尼暴露量,从而降低疗效。
福巴替尼对其他药物的影响
福巴替尼是P-gp和乳腺癌耐药蛋白(BCRP)的抑制剂。对于合用的P-gp或BCRP敏感底物药物,需更频繁地监测其不良反应,并根据其说明书减少剂量,因福巴替尼可能增加这些药物的暴露量。
药物过量
尚不明确。若发生过量,需对症支持治疗。
药代动力学
吸收:达峰时间约2小时,高脂饮食可降低吸收率。
分布:蛋白结合率95%,表观分布容积66L。
代谢:主要经CYP3A代谢,少量经CYP2C9/CYP2D6。
排泄:91%经粪便排出,9%经尿液排出,半衰期2.9小时。
贮存方法
20℃-25℃(允许15℃-30℃短期存放)。铝塑泡罩板,防儿童开启设计。
研发公司
日本Taiho Oncology(日本太浩制药)