拉罗替尼(Larotrectinib)是一种高选择性酪氨酸激酶抑制剂,通过靶向抑制神经营养性酪氨酸受体激酶(NTRK)基因融合产生的TRKA、TRKB和TRKC蛋白的活性,阻断其下游信号通路,从而抑制肿瘤细胞的增殖和存活。该药适用于治疗携带NTRK基因融合的实体瘤患者,具有广谱抗肿瘤活性。
药品称呼
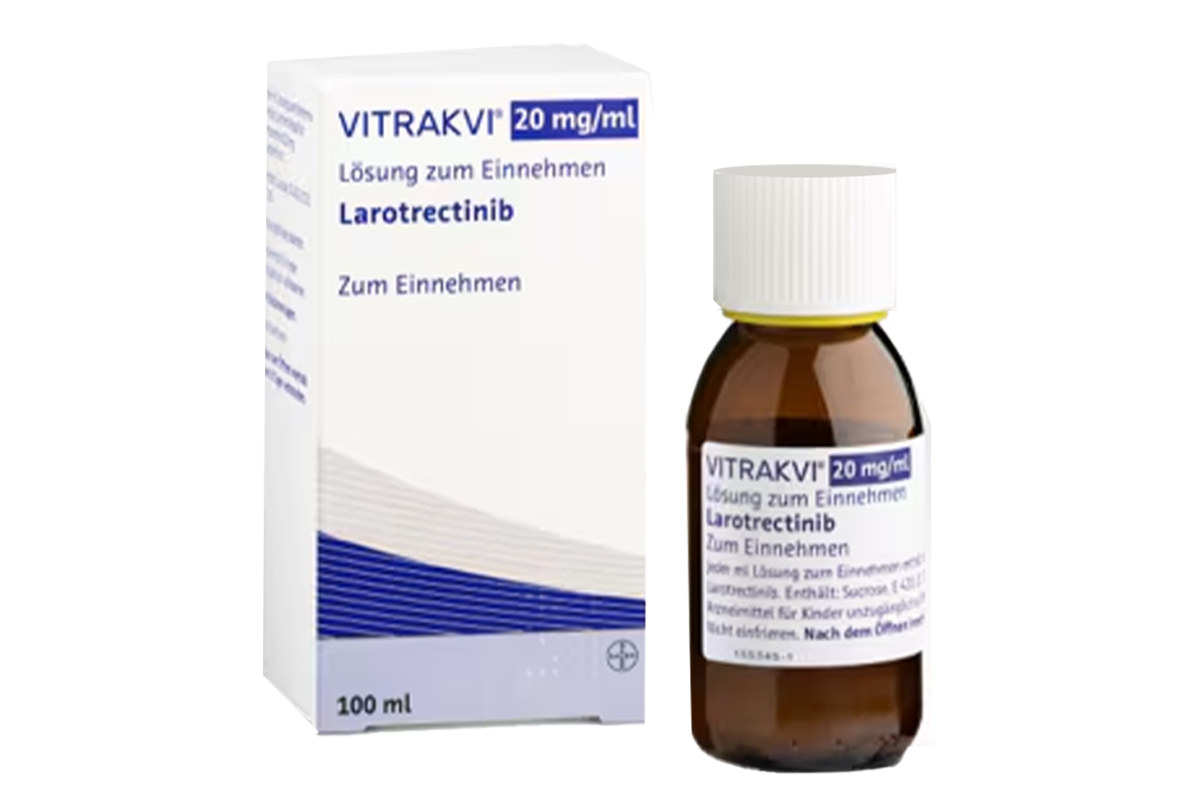
通用名:拉罗替尼(Larotrectinib)
商品名:Vitrakvi
适应靶点
神经营养性酪氨酸受体激酶(NTRK1、NTRK2、NTRK3)基因融合蛋白。
适应症和适应人群
适应症
1、用于治疗成人及儿童患者中携带NTRK基因融合的实体瘤,且需满足以下条件:
2、无已知获得性耐药突变;
3、肿瘤为转移性或手术切除可能导致严重并发症;
4、无满意替代治疗方案或既往治疗后疾病进展。
适应人群
需通过FDA批准的检测确认NTRK基因融合状态。对于分泌性乳腺癌、乳腺类似分泌性癌(MASC)、先天性中胚层肾瘤(CMN)或婴儿纤维肉瘤患者,可考虑未经NTRK重排检测直接用药。
规格与性状
规格
胶囊:25mg*60粒/瓶;100mg*60粒/瓶;
口服溶液:20mg/ml*100ml/瓶/盒;20mg/ml*50ml*2瓶/盒。
性状
胶囊:
25mg:白色不透明硬胶囊,印有蓝色“BAYER”十字及“25mg”字样;
100mg:白色不透明硬胶囊,印有蓝色“BAYER”十字及“100mg”字样。
口服溶液:
20mg/mL(100mL装):澄清黄色至橙色溶液;
20mg/mL(50mL×2装):无色至黄色/橙色/红色/棕色溶液。
主要成分
活性成分:拉罗替尼硫酸盐(Larotrectinib sulfate)。
用法用量
1、推荐剂量
体表面积≥1m²的成人和儿童
口服100mg,每日2次;
体表面积<1m²的儿童
口服100mg/m²,每日2次(最大剂量100mg/次)。
2、剂量调整
肝毒性
根据ALT/AST升高程度暂停或减量;
不良反应
按严重程度分三级减量(首次减至75mg,第二次50mg,第三次25mg/m²);
肝损伤患者
中重度(Child-Pugh B/C)需减量50%。
3、给药方法
胶囊需整粒吞服,口服溶液需冷藏,开封后分别于90天(100mL装)或31天(50mL装)内用完。
不良反应
常见不良反应(≥20%)
实验室异常
AST/ALT升高、贫血、低白蛋白血症、碱性磷酸酶升高;
临床症状
肌肉骨骼疼痛、疲劳、呕吐、咳嗽、便秘、发热、腹泻、头晕、皮疹等。
严重不良反应
中枢神经系统效应(如认知障碍、情绪障碍);
骨折(7%患者发生,多与轻微外伤相关);
肝毒性(8%患者出现3-4级ALT/AST升高)。
注意事项
中枢神经系统影响
监测头晕、认知功能下降等症状,避免驾驶或操作机械;
骨折风险
评估疼痛或活动异常,尤其儿童患者;
肝毒性监测
治疗前及治疗初期每2周检测肝功能;
胚胎-胎儿毒性
育龄患者需采取有效避孕措施;
药物相互作用
避免联用强效CYP3A4抑制剂/诱导剂。
特殊人群用药
孕妇:可能致胎儿畸形,禁用;
哺乳期:治疗期间及末次给药1周内停止哺乳;
儿童:安全性及有效性已确立,但需注意呕吐、发热等不良反应发生率较高;
老年人:无需调整剂量;
肝损伤患者:中重度需减量。
禁忌症
无明确禁忌症。
药物相互作用
CYP3A4强效抑制剂(如伊曲康唑):避免联用,必要时减量50%;
CYP3A4强效诱导剂(如利福平):避免联用,必要时加倍剂量;
敏感CYP3A4底物(如咪达唑仑):联用可能增加其血药浓度。
药物过量
尚不明确,如发生需对症支持治疗。
药代动力学
吸收:生物利用度34%,高脂饮食降低Cmax35%;
分布:血浆蛋白结合率70%,表观分布容积48L;
代谢:主要经CYP3A4代谢;
排泄:58%经粪便、39%经尿液排出,半衰期2.9小时。
贮存方法
胶囊:室温(20-25°C)保存;
口服溶液:冷藏(2-8°C),不可冷冻。
研发公司
德国拜耳