Kalydeco(ivacaftor)是一种处方药,用于治疗囊性纤维化(CF)。通过靶向囊性纤维化跨膜转导调节因子(CFTR)基因上的特定突变,增强CFTR蛋白的功能,从而改善CF患者的呼吸道症状。以下是基于Kalydeco(ivacaftor)FDA说明书内容,整理出来的药品适应症、用法用量、不良反应及注意事项等。内容仅供参考,请谨遵医嘱。
药品称呼
通用名称:ivacaftor
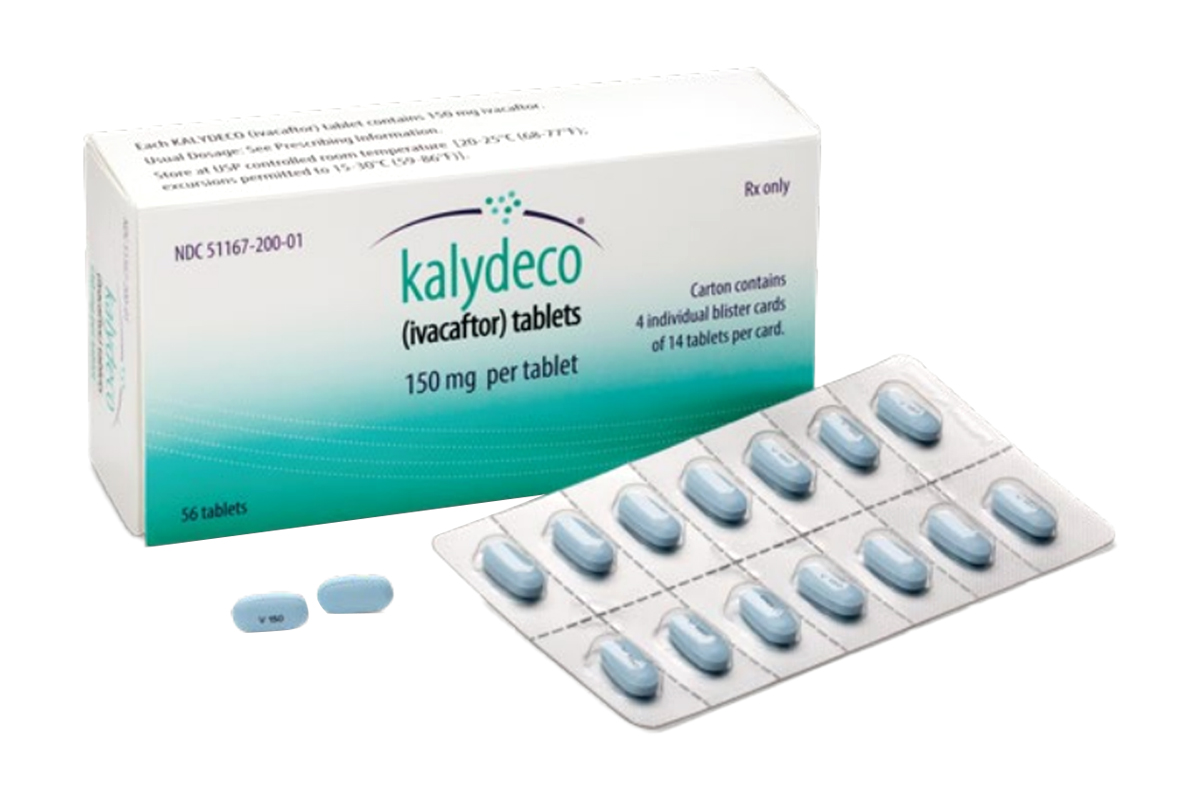
商品名称:Kalydeco
适应靶点
囊性纤维化跨膜转导调节因子(CFTR)基因上的特定突变。
适应症和适应人群
Kalydeco适用于治疗年龄在1个月及以上的囊性纤维化患者,这些患者需至少携带一个对Kalydeco敏感的CFTR基因突变。
规格与性状
规格
150mg*56片/盒。
性状
为浅蓝色、薄膜包衣。每片片剂一面印有“V150”字样,另一面为空白。
主要成分
活性成分:ivacaftor。
辅料:胶体二氧化硅、交联羧甲基纤维素钠、一水乳糖、硬脂酸镁等辅料。
用法用量
1、成人和6岁及以上儿童
每次口服150毫克Kalydeco片剂,每日两次,间隔12小时,随含脂肪的食物一起服用。
2、1个月至6岁以下儿童
根据体重调整Kalydeco口服颗粒剂的剂量,随含脂肪的食物或液体一起服用。
3、漏服处理
若漏服一剂Kalydeco,且距下次服药时间不超过6小时,应尽快补服;
若已超过6小时,则跳过该剂,继续按常规时间服用下一剂,切勿一次服用两剂以弥补漏服的剂量。
具体您可以阅读Kalydeco完整用法用量信息,建议在医生的指导下正确用药。推荐文章:Kalydeco(ivacaftor)的用法用量。
不良反应
1、常见不良反应
Kalydeco可能引起的不良反应包括头痛、咽喉痛、上呼吸道感染、鼻塞、腹痛、鼻咽炎、腹泻、皮疹、恶心和眩晕等。
2、严重的不良反应
包括肝酶升高、过敏反应和可能的白内障等。患者在使用Kalydeco期间应定期进行肝功能和眼科检查。
具体您可以阅读Kalydeco完整不良反应信息,建议在医生的指导下正确用药。推荐文章:Kalydeco(ivacaftor)的不良反应。
注意事项
转氨酶监测:治疗前及第一年每3个月需监测ALT/AST,之后每年一次,若升高超过正常上限5倍应停药并评估是否重启。
超敏反应处理:出现超敏反应症状时应立即治疗,并评估是否继续使用本品。
颅内高压警惕:如出现异常头痛或视觉障碍等疑似颅内高压症状,应立即停药并就医,监测至症状缓解,尤其注意维生素A水平升高者风险更高。
避免CYP3A诱导剂:强效CYP3A诱导剂(如利福平、圣约翰草)会显著降低kalydeco疗效,禁止合用。
儿科白内障筛查:所有儿科患者治疗前须行基线眼科检查,并在治疗期间定期随访以监测白内障风险。
特殊人群用药
【孕妇】由于人类妊娠期间使用kalydeco的数据有限,动物研究未显示致畸性或对胎儿发育的不良影响,但在妊娠期使用需权衡母体治疗需求与胎儿潜在风险。
【哺乳期女性】未知kalydeco是否分泌至人类母乳中及其对婴儿的影响,动物实验显示其可进入大鼠乳汁,哺乳期使用时需权衡母乳喂养益处与药物对婴儿的潜在风险。
【具有生殖潜力的男性和女性】动物研究在高剂量下提示可能影响生育力,但正常治疗剂量下无影响,使用本品无需特殊限制,但应注意对生殖系统的潜在影响。
【儿童使用】1个月至17岁患者的安全性和有效性已确立,但需注意白内障风险并进行眼科检查;1个月以下婴儿的安全性和有效性尚未确定,不推荐使用。
【老年人使用】囊性纤维化主要影响儿童和年轻人,65岁及以上患者的反应数据不足,使用时应谨慎评估个体情况。
【肾功能损害】轻至中度肾功能损害患者无需调整剂量,重度损害或终末期肾病患者使用需谨慎考虑。
【肝功能损害】1个月至6个月以下肝功能损害患者不推荐使用;6个月以上轻度损害无需调整剂量,中度损害需减量,重度损害需谨慎权衡利弊并降低剂量。
禁忌症
尚不明确。
药物相互作用
CYP3A抑制剂
Kalydeco是CYP3A的敏感底物。与强效CYP3A抑制剂(如酮康唑、伊曲康唑、泊沙康唑、伏立康唑、泰利霉素、克拉霉素)同服,Kalydeco暴露量显著增加;与中度CYP3A抑制剂(如氟康唑、红霉素)同服,Kalydeco暴露量升高3倍。含葡萄柚的食物或饮料可能中度抑制CYP3A,增加Kalydeco暴露量,治疗期间需避免食用。
CYP3A诱导剂
与强效CYP3A诱导剂(如利福平、利福布汀、苯巴比妥、卡马西平、苯妥英、圣约翰草)同服,Kalydeco暴露量显著降低约9倍,可能降低疗效,不推荐合并使用。
环丙沙星
与环丙沙星同服对Kalydeco暴露量无影响,无需调整剂量。
CYP2C9底物
Kalydeco可能抑制CYP2C9,与华法林同服时需监测国际标准化比值(INR);与格列美脲、格列吡嗪合用时需谨慎。
CYP3A和/或P-gp底物
Kalydeco及其代谢产物M1可能抑制CYP3A和P-gp,与敏感CYP3A底物(如咪达唑仑)或敏感P-gp底物(如地高辛)同服时,可能增加后者暴露量,延长其治疗效果和不良反应持续时间。与地高辛、环孢素、他克莫司等合用时,需谨慎并进行适当监测。
药物过量
Kalydeco过量的处理措施尚不明确。若发生过量,应立即就医。
药代动力学
吸收:健康志愿者在进食状态下口服单剂150mg本品后,血药峰浓度(Tmax)约在4小时达到,曲线下面积(AUC)均值为10600(±5260)ng・hr/mL,峰浓度(Cmax)均值为768(±233)ng/mL。
分布:kalydeco的血浆蛋白结合率约为99%,主要结合于α1-酸性糖蛋白和白蛋白,不与人类红细胞结合。
消除:单剂给药后,kalydeco的表观终末半衰期约为12小时。健康受试者与CF患者的表观清除率(CL/F)相似,150mg剂量下健康受试者的CL/F均值为17.3(±8.4)L/hr。
代谢:kalydeco在人体内广泛代谢,主要通过CYP3A酶代谢。
排泄:口服给药后,kalydeco经代谢转化后主要通过粪便排泄(占总剂量的87.8%),主要代谢产物M1和M6占排泄总剂量的约65%(M1占22%,M6占43%),原形药物经尿液排泄量可忽略不计。
贮存方法
密封,置于20℃-25℃室温下储存,允许短期偏离至15℃-30℃。
研发公司
美国Vertex(美国福泰制药)