



Jemperli是第一个被批准用于治疗子宫内膜癌的抗PD-1疗法,美国FDA在2021年4月23日宣布已加速批准抗PD-1疗法Jemperli(Dostarlimab-gxly,前称TSR-042),作为一种单药疗法,用于治疗接受含铂化疗期间或之后病情进展、错配修复缺陷(dMMR)复发性或晚期子宫内膜癌患者。
据悉,Jemperli是一款人源化抗PD-1单克隆抗体,与PD-1受体结合,并阻断其与配体PD-L1和PD-L2的相互作用。该药通过靶向PD-1/PD-L1(存在于人体免疫细胞和一些癌细胞上的蛋白质)的细胞途径发挥作用。Jemperli通过阻断这一途径帮助人体免疫系统对抗癌细胞。
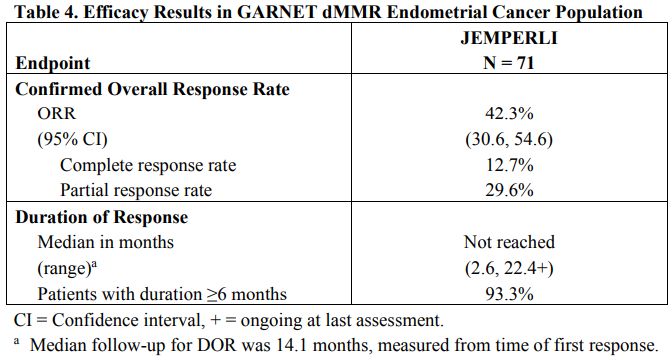
从临床数据来看,此次的加速批准是基于一项多中心、多队列、开放标签的GARNET研究(NCT02715284)。疗效人群包括71例错配修复缺陷复发或晚期子宫内膜癌患者,这些患者在含铂方案治疗期间或治疗后出现进展。研究的主要疗效指标为总客观缓解率(ORR)和持续反应时间(DOR)。
入组患者的人群特征包括:中位年龄64岁;82%的患者为白人,3%的患者为亚洲人,1%的患者为黑人;ECOG评分为0(32%)或1(68%)。在研究开始时,66%的错配修复缺陷复发或晚期子宫内膜癌患者为 IV期疾病;最常见的组织学类型是子宫内膜样癌I型(70%),其次是浆液型(6%)和混合型和未分化型(各占2.8%)。
所有错配修复缺陷复发或晚期子宫内膜癌患者之前都接受过抗癌治疗,其中90%的患者之前接受过抗癌手术,79%的患者之前接受过抗癌放疗。大约40%的患者既往接受过2个或更多的抗癌治疗。大约11%的患者接受了3个方案,4%的患者之前接受了4个或更多的方案。
研究数据显示:中位随访时间为14.1个月;客观缓解率(ORR)为42.3%,完全缓解(CR)为12.7%,部分缓解(PR)为29.6%。中位持续反应时间(DOR)为NR(尚未达到);在病情缓解的患者中,93%的患者缓解持续时间≥6个月。
该研究中,Jemperli常见的副作用包括疲劳、恶心、腹泻、贫血和便秘。Jemperli可引起被称为免疫介导性副作用的严重疾病,包括健康器官的炎症,如肺部(肺炎)、结肠(结肠炎)、肝脏(肝炎)、内分泌腺(内分泌疾病)和肾脏(肾炎)。
注:以上资讯来源于网络,由医伴旅整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
