那他珠单抗是一种整合素受体拮抗剂,通过抑制α4-整合素介导的白细胞黏附和迁移,发挥抗炎作用。由于存在进行性多灶性白质脑病(PML)等严重风险,仅通过处方计划限制使用,适用于特定的多发性硬化和克罗恩病患者。
药品称呼
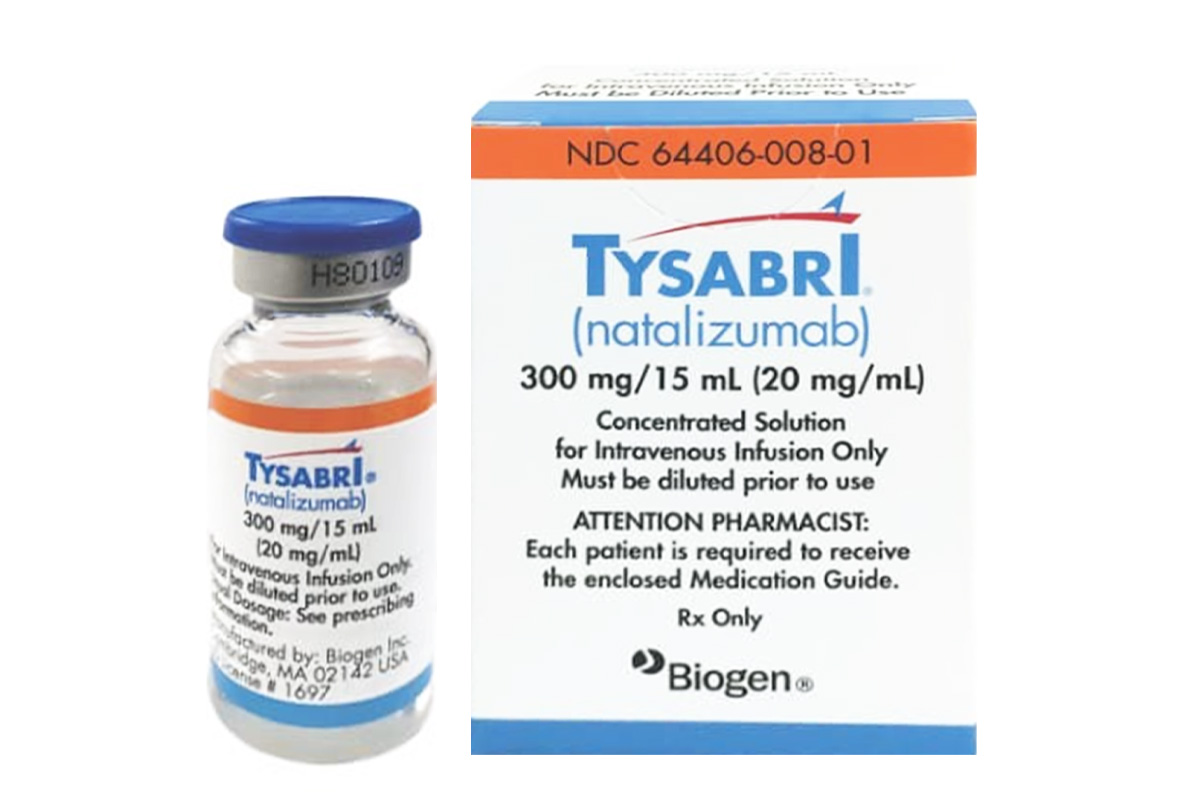
通用名称:那他珠单抗、Natalizumab
商品名称:Tysabri
其他名称:他利珠单抗、莫那利珠单抗
适应靶点
那他珠单抗靶向结合白细胞表面的α4-亚基,可抑制α4β1和α4β7整合素与相应配体(如血管细胞黏附分子-1、黏膜地址素细胞黏附分子-1)的相互作用,阻止白细胞跨内皮迁移至炎症组织。
适应症和适应人群
1.多发性硬化(MS)
适用于成人复发型多发性硬化,包括临床孤立综合征、复发缓解型疾病及活动性继发进展型疾病,作为单药治疗。使用时需权衡获益与PML风险。
2.克罗恩病(CD)
适用于成人中重度活动性克罗恩病患者,此类患者存在炎症证据,且对传统治疗及肿瘤坏死因子-α(TNF-α)抑制剂反应不足或不耐受。不得与免疫抑制剂或TNF-α抑制剂联用。
规格与性状
规格:注射剂,300mg/15mL(20mg/mL)。
性状:无色、澄清至微乳光溶液,装于单剂量瓶中,需稀释后静脉输注。
主要成分
活性成分:Natalizumab。
辅料:氯化钠(123mg)、磷酸二氢钠一水合物(17mg)、磷酸氢二钠七水合物(7.24mg)、聚山梨酯80(3mg),溶于注射用水,pH值为6.1。
用法用量
1.多发性硬化(MS)
仅限在MSTOUCH处方计划中注册的处方医师开具。推荐剂量为300mg,静脉输注1小时,每4周1次。
2.克罗恩病(CD)
仅限在CDTOUCH处方计划中注册的处方医师开具。推荐剂量为300mg,静脉输注1小时,每4周1次。不得与免疫抑制剂(如6-巯基嘌呤、硫唑嘌呤、环孢素、甲氨蝶呤)或TNF-α抑制剂联用,可继续使用氨基水杨酸类药物。
若患者在诱导治疗12周内未出现治疗获益,应停用那他珠单抗。
若患者开始使用那他珠单抗时正在接受慢性口服皮质类固醇治疗,应在出现治疗获益后尽快开始激素减量;若6个月内无法停用口服皮质类固醇,应停用那他珠单抗。除初始6个月减量期外,若患者1年内需要额外使用激素超过3个月以控制克罗恩病,应考虑停用那他珠单抗。
3.稀释说明
制备静脉输注溶液时需采用无菌技术,每瓶仅供单次使用,剩余部分需丢弃。
稀释前检查药液,若存在可见颗粒或变色,不得使用。
用无菌针头和注射器从瓶中抽取15mL那他珠单抗,注入100mL0.9%氯化钠注射液(USP)中,不得使用其他静脉稀释剂。
轻轻倒置稀释后的溶液以完全混合,不得摇晃;输注前再次目视检查颗粒物质。
最终稀释溶液的浓度为2.6mg/mL。
稀释后应立即输注,或在2-8℃冷藏,48小时内使用。若冷藏保存,使用前需使溶液恢复至室温,不得冷冻。
4.给药说明
将300mg那他珠单抗溶于100mL0.9%氯化钠注射液中,输注约1小时(输注速率约为5mg/分钟),不得作为静脉推注或弹丸注射给药。输注完成后,用0.9%氯化钠注射液冲洗。
输注期间需观察患者,若出现任何过敏反应迹象或症状,应立即停止输注。
输注后,前12次输注需在完成后观察患者1小时;若患者已接受12次输注且无过敏反应证据,第13次及后续输注的术后观察时间由临床判断决定。
给药时使用过滤装置的效果尚未评估,不得将其他药物注入输注装置的侧端口或与那他珠单抗混合。
具体您可以阅读那他珠单抗完整用法用量信息,建议在医生的指导下正确用药。推荐文章:那他珠单抗的用法用量。
不良反应
1.常见不良反应(发生率≥10%)
多发性硬化:头痛、疲劳、关节痛、尿路感染、下呼吸道感染、胃肠炎、阴道炎、抑郁、肢体疼痛、腹部不适、非特异性腹泻、皮疹。
克罗恩病:头痛、上呼吸道感染、恶心、疲劳。
2.严重不良反应
进行性多灶性白质脑病(PML):一种由JC病毒引起的机会性脑部感染,可导致死亡或严重残疾,风险因素包括抗JCV抗体阳性、治疗持续时间(尤其超过2年)、既往使用免疫抑制剂。
疱疹感染:包括致命性疱疹性脑炎和脑膜炎,及可导致失明的急性视网膜坏死,出现时需停药并对症治疗。
肝毒性:包括需肝移植的肝功能衰竭,出现黄疸或其他肝损伤证据时需停药。
过敏反应:包括过敏性休克(发生率<1%),多在输注后2小时内发生,表现为荨麻疹、头晕、发热等,出现后需永久停药。
感染风险增加:包括肺炎、尿路感染等,长期使用可能出现机会性感染(如肺鸟分枝杆菌复合体感染、曲霉肿等)。
血液异常:包括血小板减少症(如免疫性血小板减少性紫癜),新生儿可能出现血小板减少和贫血。
具体您可以阅读那他珠单抗完整副作用信息,建议在医生的指导下正确用药。推荐文章:那他珠单抗的副作用。
注意事项
1.进行性多灶性白质脑病(PML)
监测患者是否出现PML相关症状(如进行性单侧肢体无力、肢体笨拙、视力障碍、思维/记忆/定向力改变导致意识模糊和人格改变),出现时立即停药并进行诊断评估(包括脑部钆增强MRI、脑脊液JC病毒DNA检测)。
治疗前MS患者需进行脑部MRI,CD患者可考虑基线脑部MRI,以区分原有病灶与新发病灶。
停药后至少6个月内仍需监测PML症状,尚无有效预防或治疗PML的干预措施。
2.TOUCH®处方计划
那他珠单抗仅通过风险评估与缓解策略(REMS)下的TOUCH®处方计划提供,医师、患者、药房及输注中心需符合相应要求(如医师需认证、患者需登记并签署知情同意书、定期评估等)。
3.疱疹感染
监测患者是否出现疱疹性脑炎/脑膜炎(如发热、头痛、意识模糊)或急性视网膜坏死(如视力下降、眼红、眼痛)症状,出现时停药并对症治疗。
4.肝毒性
监测肝功能,出现黄疸或其他显著肝损伤证据时停药。
5.过敏反应与抗体形成
输注期间及之后需观察过敏反应,出现后永久停药。
若怀疑存在持续性抗体,需进行抗体检测;短期暴露后长期停药再重新用药者,抗体及过敏反应风险增加,重新用药前可检测抗体。
6.免疫抑制与感染
那他珠单抗可能增加感染风险,监测患者感染迹象,慢性免疫功能低下者通常不应使用。
克罗恩病患者使用那他珠单抗时,若正在接受慢性皮质类固醇治疗,需在出现治疗获益后尽快减量。
7.血液异常
监测患者出血异常迹象,怀疑血小板减少时停药;宫内暴露于那他珠单抗的新生儿需进行全血细胞计数(CBC)。
8.免疫接种
接种疫苗对那他珠单抗使用者的影响及活疫苗的二次传播风险尚未明确,说明书中尚未明确具体指导意见。
特殊人群用药
【孕妇】可能导致胎儿伤害,已有新生儿血小板减少和贫血的报告。宫内暴露于那他珠单抗的新生儿需进行CBC;孕妇使用需权衡获益与风险。
【哺乳期女性】那他珠单抗可进入人乳,对乳儿及乳汁分泌的影响尚未明确。需权衡母乳喂养的益处与母亲的治疗需求及药物对乳儿的潜在风险。
【具有生殖潜力的男性和女性】说明书中尚未明确。
【儿童使用】18岁以下儿童多发性硬化或克罗恩病患者的安全性和有效性尚未确立,那他珠单抗不用于儿科患者。
【老年人使用】临床研究中65岁及以上患者数量不足,无法确定其反应是否与年轻患者不同,其他临床经验未发现差异。
【肾功能损害】说明书中尚未明确(未研究肾功能不全患者的药代动力学)。
【肝功能损害】说明书中尚未明确(未研究肝功能不全患者的药代动力学)。
禁忌症
曾患进行性多灶性白质脑病(PML)者。
对那他珠单抗有过敏反应史者(包括荨麻疹至过敏性休克)。
药物相互作用
1.克罗恩病患者
不得与免疫抑制剂(如6-巯基嘌呤、硫唑嘌呤、环孢素、甲氨蝶呤)或TNF-α抑制剂联用;使用慢性皮质类固醇的患者需逐渐减量。
2.多发性硬化患者
通常不应与慢性免疫抑制剂或免疫调节剂联用,因可能增加PML及其他感染风险。
尚未确立那他珠单抗与抗肿瘤药、免疫抑制剂或免疫调节剂联用的安全性和有效性。
药物过量
超过300mg剂量的安全性尚未充分评估,最大安全给药剂量尚未确定。
药代动力学
1.多发性硬化患者
重复静脉输注300mg后,平均峰浓度为110±52μg/mL,稳态谷浓度为23-29μg/mL,达稳态时间约24周(每4周给药)。
平均半衰期11±4天,分布容积5.7±1.9L,清除率16±5mL/小时。
体重增加可使清除率增加(体重增加43%,清除率增加32%);存在持续性抗那他珠单抗抗体时,清除率约增加3倍。
2.克罗恩病患者
重复静脉输注300mg后,平均峰浓度为101±34μg/mL,稳态谷浓度为10±9μg/mL,达稳态时间约16-24周(每4周给药)。
平均半衰期10±7天,分布容积5.2±2.8L,清除率22±22mL/小时。
存在抗那他珠单抗抗体时,清除率增加。
贮存方法
未稀释的单剂量瓶:2-8℃冷藏(36-46°F),不得超过标签上的有效期,不得摇晃或冷冻,避光保存。
稀释后的溶液:2-8℃冷藏(36-46°F),48小时内使用。
研发公司
Biogen Inc.(美国百健)