必妥维为复方抗病毒制剂,含整合酶抑制剂比克替拉韦(BIC)、核苷类逆转录酶抑制剂恩曲他滨(FTC)和丙酚替诺福韦(TAF)。其作用机制通过多靶点抑制HIV-1复制:比克替拉韦特异性阻断病毒DNA整合至宿主基因组,恩曲他滨和丙酚替诺福韦干扰病毒逆转录过程。三药协同作用可最大限度抑制病毒载量,适用于HIV-1感染的长期控制。
药品名称
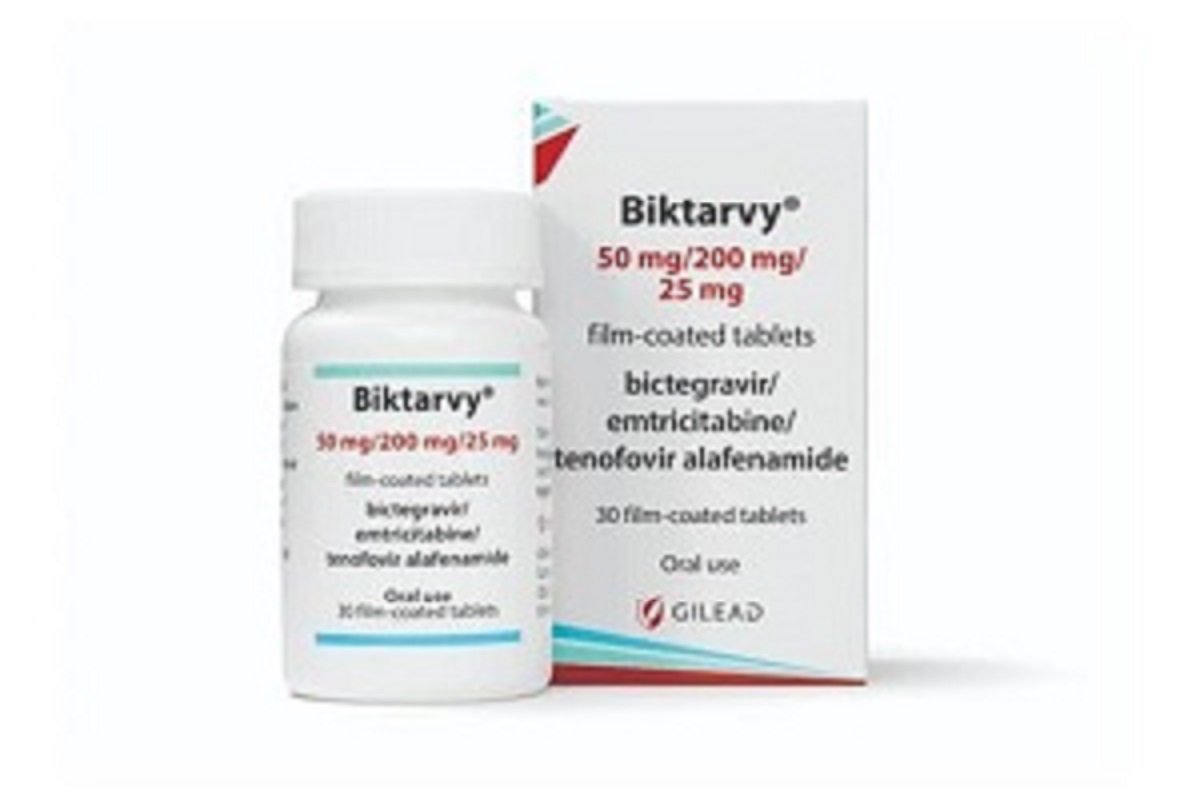
通用名称:比克恩丙诺片、bictegravir/emtricitabine/tenofovir alafenamide
商品名称:必妥维、Biktarvy
适应靶点
HIV-1整合酶、逆转录酶
适应症及适用人群
1、适应症
成人及≥12岁、体重≥14kg青少年HIV-1感染者的抗病毒治疗。
既往未接受抗逆转录治疗(ART)或需替换现有方案的患者。
2、适用人群限制
对整合酶抑制剂、核苷类似物耐药者需评估敏感性后使用。
轻度至中度肾功能不全者无需调整剂量,重度肾功能不全需减量。
规格与性状
规格:50mg/200mg/25mg*30片/盒。
性状:浅蓝色椭圆形薄膜衣片,一面凹刻“GSI”,另一面凹刻“778”。
主要成分
活性成分:比克替拉韦钠、恩曲他滨、富马酸丙酚替诺福韦。
用法用量
1、标准剂量
成人及青少年(≥35kg):每日1次,每次1片,随餐或空腹服用。
2、特殊剂量调整
肾功能不全:eGFR30-49mL/min者减量至每48小时1片;eGFR<30mL/min者禁用。
血液透析患者:无推荐剂量,需密切监测。
3、漏服处理
若距下次用药>18小时,立即补服;否则跳过本次剂量。
具体您可以阅读必妥维完整用法用量信息,建议在医生的指导下正确用药。推荐文章:必妥维(Biktarvy)的用法用量。
不良反应
1、常见反应(≥5%)
胃肠道:恶心、腹泻。
神经系统:头痛、头晕。
2、严重反应
免疫反应重建综合征(如发热、淋巴结肿大)。
肾功能损害(血肌酐升高、蛋白尿)。
乳酸酸中毒(罕见,但可能致命)。
建议您阅读必妥维完整副作用信息,推荐文章:必妥维(Biktarvy)的副作用。
注意事项
1、用药前评估
检测HIV-1基因型耐药性,确认对BIC敏感。
筛查乙肝/丙肝共感染(TAF可能影响肝炎活动)。
2、监测要求
每3-6个月检测肾功能、骨密度及血脂变化。
3、警告
停药后病毒载量可能反弹,需终身治疗。
与含多价阳离子药物(如抗酸剂)联用需间隔至少2小时。
特殊人群用药
【孕妇】用药对孕妇及胎儿的影响尚不明确,应在医生权衡利弊后谨慎使用,用药期间需密切监测母婴状况。
【哺乳期女性】由于药物可能通过乳汁传递给婴儿,哺乳期女性使用必妥维时,应考虑药物对婴儿的潜在风险,在医生指导下决定是否继续哺乳或用药。
【具有生殖潜力的男性和女性】使用必妥维期间,有生殖潜力的男性和女性应采取有效的避孕措施,防止意外怀孕,避免药物对胎儿产生潜在影响。
【儿童使用】体重至少14kg的儿科患者可使用,但体重≥14kg至<25kg的儿科患者与体重≥25kg的儿科患者在用药剂量上有所不同。对于无法整片吞服的体重≥14kg至<25kg的儿科患者,可将药片掰开在约10分钟内分服。使用过程中需密切关注儿童的生长发育和药物不良反应。
【老年人使用】老年人可能存在多种合并症,使用必妥维时,需充分考虑药物安全性和药物相互作用,必要时可能需调整剂量或加强监测。
【肾功能损害】对于体重≥25kg且有严重肾损伤(估计肌酐清除率<30ml/min)的患者,除了肌酐清除率<15ml/min且正在接受慢性血液透析的病毒学抑制患者外,不推荐使用必妥维;对于体重≥14kg至<25kg且肌酐清除率<30ml/min的患者,不推荐使用必妥维。肾功能损害患者使用时,需密切监测肾功能和药物不良反应,可能需调整治疗方案。
【肝功能损害】对于有严重肝损伤(Child-Pugh分级C级)的患者,不推荐使用必妥维。肝功能损害患者使用时,需密切监测肝功能和药物不良反应,根据肝功能情况调整治疗方案。
禁忌症
对BIC、FTC、TAF或辅料严重过敏者。
合并使用多非利特、利福平等强效CYP3A诱导剂。
肌酐清除率<30mL/min或需血液透析者。
药物相互作用
酶/转运体相关相互作用
诱导剂影响:诱导P-糖蛋白(P-gp)或同时诱导细胞色素P4503A(CYP3A)和尿苷二磷酸葡萄糖醛酸基转移酶1A1(UGT1A1)的药物,可显著降低必妥维成分的浓度。这是因为这些诱导剂会加速必妥维中药物成分的代谢过程,使其在体内的有效浓度降低,从而可能影响治疗效果,导致HIV病毒学失败风险增加。
抑制剂影响:抑制P-gp、乳腺癌耐药蛋白(BCRP)或同时抑制CYP3A和UGT1A1的药物,可能显著增加必妥维成分的浓度。抑制剂会阻碍必妥维药物成分的正常代谢和转运,使其在体内蓄积,浓度升高,这可能增加不良反应的发生几率,如肝脏毒性、胃肠道不适、神经系统症状(如头晕、头痛、失眠等)以及代谢紊乱(如血脂、血糖异常)等。
对其他药物的影响:必妥维可以增加有机阳离子转运体2(OCT2)或多药和毒素挤出蛋白1(MATE1)底物药物的浓度。这可能改变这些底物药物在体内的药代动力学过程,影响其疗效或增加不良反应风险。
影响肾功能的药物相互作用
必妥维与降低肾功能或竞争主动肾小管分泌的药物合用,可能增加恩曲他滨和替诺福韦的浓度。这是因为这些药物影响了必妥维中恩曲他滨和替诺福韦在肾脏的排泄和重吸收过程,导致其在体内的浓度升高,进而提高不良反应发生风险,如增加肾毒性的风险,表现为肾功能损害,如血肌酐升高、蛋白尿、肾小球滤过率下降等。长期或严重的肾毒性可能会导致肾功能衰竭。
药物过量
症状:头痛、恶心加重,严重时可能出现急性肾损伤。
处理:无特效解毒剂,支持治疗为主,必要时血液透析(TAF可通过透析清除)。
药代动力学
吸收:BIC、FTC、TAF生物利用度分别为72%、93%、80%。
代谢:BIC经UGT1A1代谢,TAF经P-糖蛋白转运。
消除:BIC半衰期约18小时,FTC经肾脏排泄,TAF以原型经粪便/尿液排出。
贮存方法
密闭保存于25℃以下干燥处,避免潮湿。远离儿童,有效期36个月。
研发公司
美国吉利德