菲达替尼是一种口服激酶抑制剂,通过选择性抑制Janus相关激酶2(JAK2)和FMS样酪氨酸激酶3(FLT3)的活性发挥作用。JAK2的异常激活与骨髓增殖性肿瘤(MPNs,如骨髓纤维化和真性红细胞增多症)密切相关。菲达替尼通过阻断JAK2介导的信号转导和转录激活因子(STAT3/5)的磷酸化,抑制细胞增殖并诱导凋亡,从而改善脾肿大、贫血等症状。
药品称呼
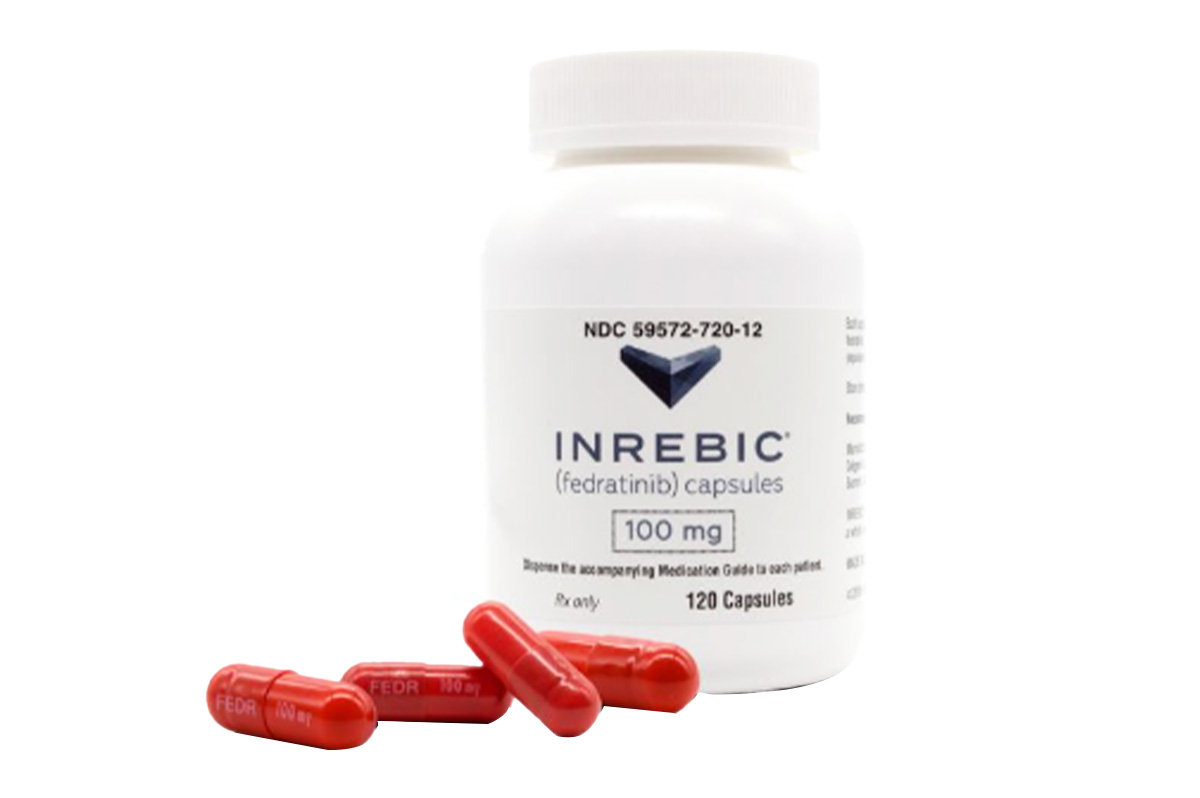
通用名称:菲达替尼、Fedratinib
商品名称:Inrebic
适应靶点
JAK2、FLT3
适应症和适应人群
适应症
用于治疗中危-2或高危的原发性骨髓纤维化(MF)或继发性骨髓纤维化(包括真性红细胞增多症后骨髓纤维化或原发性血小板增多症后骨髓纤维化)的成人患者。
适应人群
成年患者(年龄≥18岁),基线血小板计数≥50×10⁹/L。
规格与性状
规格
100mg*120粒/瓶。
性状
红棕色不透明硬胶囊,胶囊上印有白色“FEDR100mg”字样。
主要成分
活性成分:菲达替尼二盐酸盐一水合物。
辅料:硅化微晶纤维素、硬脂酰富马酸钠等。
用法用量
1、推荐剂量
基线血小板计数≥50×10⁹/L的患者:400毫克口服,每日1次,随餐或空腹服用。
与强效CYP3A4抑制剂联用或严重肾功能不全(肌酐清除率15-29mL/min)时:减量至200毫克每日1次。
2、给药方法
整粒吞服,或对于吞咽困难或需鼻胃管给药者,可将胶囊内容物与约180mL Ensure Plus营养液混合后立即服用(2小时内)。鼻胃管给药后需用60mL水冲洗管道。
3、剂量调整
血液学毒性(如4级血小板减少或3级伴出血):暂停给药,恢复后减量100毫克/日。
非血液学毒性(如3级以上腹泻、肝酶升高):暂停给药,恢复后减量100毫克/日。
必需联用药物:所有患者需每日口服100毫克维生素B1(硫胺素)以预防脑病。
具体您可以阅读菲达替尼完整用法用量信息,建议在医生的指导下正确用药。推荐文章:菲达替尼(fedratinib)的用法用量。
不良反应
常见不良反应(≥20%)
腹泻、恶心、贫血、呕吐。
严重不良反应
脑病(包括韦尼克脑病):发生率1.3%,可能致命。
血液学毒性:3级贫血(34%)、3级血小板减少(12%)。
胃肠道毒性:3级腹泻(5%)、呕吐(3.1%)。
肝毒性:ALT/AST升高(43%/40%)。
胰腺酶升高:3级淀粉酶/脂肪酶升高(2%/10%)。
葡萄膜炎:发生率4%,多见于日本患者。
具体您可以阅读菲达替尼不良反应内容,建议在医生的指导下正确用药。推荐文章:菲达替尼(fedratinib)的不良反应。
注意事项
脑病风险:治疗前及治疗期间需监测维生素B1水平,缺乏者禁用。
血液监测:定期检测全血细胞计数、肝肾功能、淀粉酶/脂肪酶。
心血管风险:吸烟或有心血管病史者需警惕主要不良心血管事件(MACE)。
血栓及继发恶性肿瘤:尤其吸烟者风险增加。
葡萄膜炎:出现眼痛、视力下降需立即眼科评估。
特殊人群用药
【孕妇】目前尚无菲达替尼在孕妇中使用的临床数据,但动物实验显示,菲达替尼在低于人类推荐剂量时可能导致胚胎发育异常(如骨骼变异)。临床中仅在权衡治疗获益大于对胎儿潜在风险时方可使用,且需告知孕妇可能的胎儿风险。
【哺乳期女性】菲达替尼及其代谢产物是否进入人类母乳、对母乳喂养婴儿或乳汁分泌的影响均未知;基于药物潜在毒性,母乳喂养婴儿可能面临严重不良反应风险。因此建议哺乳期女性在接受菲达替尼治疗期间及末次剂量后至少1个月内避免母乳喂养,选择其他合适的婴儿喂养方式。
【具有生殖潜力的男性和女性】说明书中尚未明确相关信息。
【儿童使用】未开展菲达替尼在儿童患者中的安全性和有效性研究,无法确定儿童使用的风险;说明书明确其在儿童患者中的安全性和有效性尚未确立,不推荐儿童使用。
【老年人使用】老年患者(>65岁)与年轻患者在菲达替尼的安全性和有效性方面无显著差异,未发现老年患者特定的额外风险;因此无需调整起始剂量,治疗期间按常规监测不良反应即可。
【肾功能损害】轻度肾功能损害(CLcr60-89mL/min)对菲达替尼暴露量无显著影响;中度(CLcr30-59mL/min)和严重(CLcr15-29mL/min)肾功能损害患者暴露量依次升高,可能增加不良反应风险。临床指导为:严重肾功能损害患者需将剂量调整为200mg每日一次;轻中度损害患者无需调整起始剂量,但中度损害者需加强监测,出现不良反应按规定调整;终末期肾病(CLcr<15mL/min)患者用药数据未明确,需谨慎评估。
【肝功能损害】轻、中、重度肝功能损害(Child-PughA、B、C级)患者的菲达替尼药代动力学无临床意义改变,未发现相关额外风险。临床无需调整起始剂量,但治疗期间需定期监测肝功能(ALT、AST、胆红素),出现肝酶升高按规定处理。
禁忌症
尚不明确。
药物相互作用
其他药物对菲达替尼的影响
强效CYP3A4抑制剂(如酮康唑):合用会显著增加菲达替尼的药效,可能加重副作用。建议将菲达替尼剂量调整为200mg每日一次,并加强副作用监测。
强效与中效CYP3A4诱导剂(如利福平、依非韦伦):合用会显著降低菲达替尼的药效,可能导致治疗失败。因此应尽量避免与这类药物同时使用。
双重CYP3A4与CYP2C19抑制剂(如氟康唑):合用会增加菲达替尼的药效和副作用风险。合用期间需密切监测,若出现不良反应,需及时调整菲达替尼剂量。
菲达替尼对其他药物的影响
CYP3A4、CYP2C19或CYP2D6底物药物(如咪达唑仑、奥美拉唑、美托洛尔):菲达替尼会增强这些药物的效果,可能增加其副作用风险。合用时需监测这些药物的副作用,并根据需要调整它们的剂量。
OCT2与MATE1/2-K底物药物(如二甲双胍):菲达替尼会降低这些药物的排泄速度,使其在体内浓度升高,可能增加副作用风险(如二甲双胍相关的乳酸酸中毒)。合用时需密切监测,并根据需要调整它们的剂量。
药物过量
尚不明确。
药代动力学
吸收:达峰时间(Tₘₐₓ)约3小时,高脂餐可增加吸收。
分布:蛋白结合率≥92%,表观分布容积1770L。
代谢:主要通过CYP3A4、CYP2C19和FMO3代谢。
排泄:77%经粪便排出(23%原形),5%经尿液排出(3%原形)。
半衰期:有效半衰期41小时,终末半衰期约114小时。
贮存方法
30℃以下保存,避免阳光直射。
研发公司
Celgene Corporation(美国新基)