



FDA已向负责研发和生产帕博利珠单抗(pembrolizumab,Keytruda)的默克公司(Merck)发出完整回复函,有关该PD-1抑制剂作为新辅助治疗联合化疗后辅助单药治疗高危早期三阴性乳腺癌(TNBC)患者的生物制剂许可证申请。
概述
该公司正在研究该回复函,以便下一步可以与FDA的指导方针相一致。
值得注意的是,该回复函不影响帕博利珠单抗的任何当前适应症,包括联合化疗用于治疗局部晚期不可切除性转移性TNBC患者,这些患者的肿瘤表达PD-L1,综合阳性评分(CPS)为10或更高。
相关试验
获得回复函的申请得到了3期KEYNOTE-522试验(NCT03036488)结果的支持,在该试验中病理完全缓解(pCR)和无事件生存期(EFS)数据是双重主要终点。在该试验中,帕博利珠单抗联合化疗对比安慰剂联合化疗作为新辅助治疗,然后帕博利珠单抗单药治疗对比安慰剂作为辅助治疗,用于TNBC患者。
研究人员招募了1174名患者,按照2:1的比例将他们随机分为试验组和对照组。帕博利珠单抗每3周给药一次,加紫杉醇每周一次和卡铂(每周或每3周一次),给药4个周期,然后帕博利珠单抗加环磷酰胺每3周一次,联合阿霉素或表阿霉素4个周期,作为术前新辅助治疗,然后帕博利珠单抗每3周一次,持续9个周期,作为术后辅助治疗。对照组中的受试者接受匹配的安慰剂和相同的化疗方案。

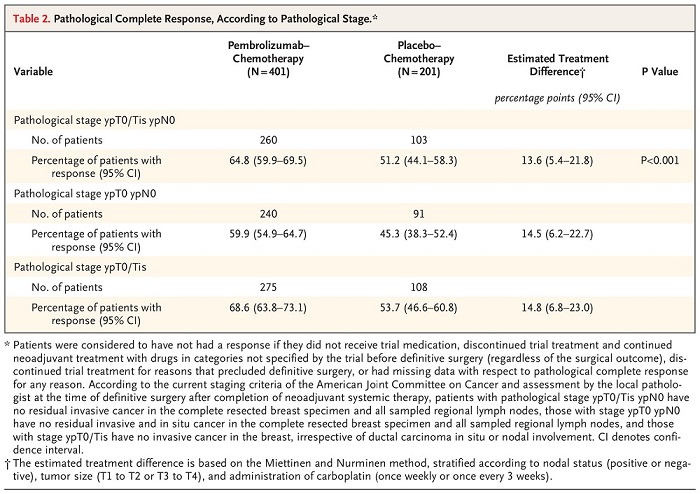
试验组患者的pCR率为64.8%,而对照组为51.2%,帕博利珠单抗引起的改善具有统计学意义(P<.001)。两组排除确定性手术、局部或远处复发或第二原发性肿瘤、任何原因死亡的疾病进展发生率分别为7.4%和11.8%(HR,0.63;95%CI,0.43-0.93)。
次要终点包括:采用确定性手术时乳腺或淋巴结无侵袭性或非侵袭性残留癌的替代定义的pCR率、总生存期、肿瘤表达PD-L1且CPS大于等于1的患者的EFS、安全性和患者报告结果。

其他
该试验继续评估EFS,因此FDA肿瘤药物咨询委员会以10票对0票赞成推迟监管决定,直到有更多的可用数据。下一次中期分析将在2021年第三季度末进行。最初,FDA在2020年7月接受了该BLA,并将处方药使用者收费法案(PDUFA)的日期定为2021年3月29日。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
