



目前,全世界至少有5000万的痴呆患者,到2050年预计将达到1.52亿,近日美国FDA加速批准LEQEMBI上市,用于治疗阿尔茨海默症,具体疗效如何?来随小编一起来看看吧!
阿尔茨海默病(Azheimer's disease,AD)俗称“老年痴呆症”,是发生于老年和老年前期,以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变。临床上常表现为记忆障碍、认知功能下降、行为障碍、生活能力逐渐下降、抽象思维和计算力损害等。
阿尔茨海默病通常隐匿起病,持续进行性发展,主要表现为认知功能减退和非认知性神经精神症状。医学上将其分为痴呆前阶段和痴呆阶段,主要区别在于患者的生活能力是否已经下降。痴呆阶段是传统意义上的阿尔茨海默病,此阶段患者认知功能损害导致了日常生活能力下降,按认知损害的程度可以分为轻、中、重三期。
阿尔茨海默病的治疗难点在于其发病机制并未完全清晰。目前,比较公认的机制是认为β淀粉样蛋白(amyloid-β,Aβ)的生成和清除失衡是神经元变性的始动因素,由于β-淀粉样蛋白水平异常,导致在大脑神经元之间形成具有神经毒性的斑块、神经元变性。
2023年1月6日,美国FDA通过加速审批途径批准渤健(Biogen)和卫材(Eisai)联合开发的LEQEMBI (lecanemab-irmb,仑卡奈单抗),用于治疗阿尔茨海默病(AD)。LEQEMBI是继Aducanumab后,全球第二款获批上市的靶向β淀粉样蛋白创新疗法,FDA曾授予此疗法快速通道资格、优先审评资格、突破性疗法认定。
LEQEMBI为一抗β淀粉样蛋白(Aβ)抗体,能通过中和和消除大脑中发现的有毒淀粉样蛋白 - β聚集体来减缓阿尔茨海默病的进展,它具有改变疾病病理,缓解疾病进展的潜力。
2022年5月,《Alzheimers Res Ther》发布了一项随机、双盲、Ⅱb 期临床试验,其目的为探讨仑卡奈单抗在三个剂量水平和两种给药方案在阿尔茨海默病患者中的剂量反应,次要疗效终点为使用正电子发射断层扫描对试验患者的脑淀粉样蛋白的变化。
试验者共招募了856名阿尔茨海默病患者,最终仅854名患者接受试验,他们被随机分成试验组和安慰剂组,其中试验组有609名患者给予仑卡奈单抗,共有三种剂量,分别是2.5 mg/kg、5 mg/kg和10 mg/kg,2.5 mg/kg仅有一种给药方案即两周给药一次(双周组),而后两种剂量均有两种给药方案,分别为两周给药一次(双周组)和一个月给药一次(月度组);安慰剂组有245名患者。
脑淀粉样蛋白的减少相较于基线的变化(次要疗效终点)如下:安慰剂组为0.004,试验组2.5 mg/kg双周组、5 mg/kg月度组、5 mg/kg双周组、10 mg/kg月度组和10 mg/kg双周组相对于基线的变化分别为0.094、0.131、0.197、0.225和0.306。试验组与安慰剂的平均差异分别为0.099,0.136,0.201,0.229和0.310,其详细数据如图1:
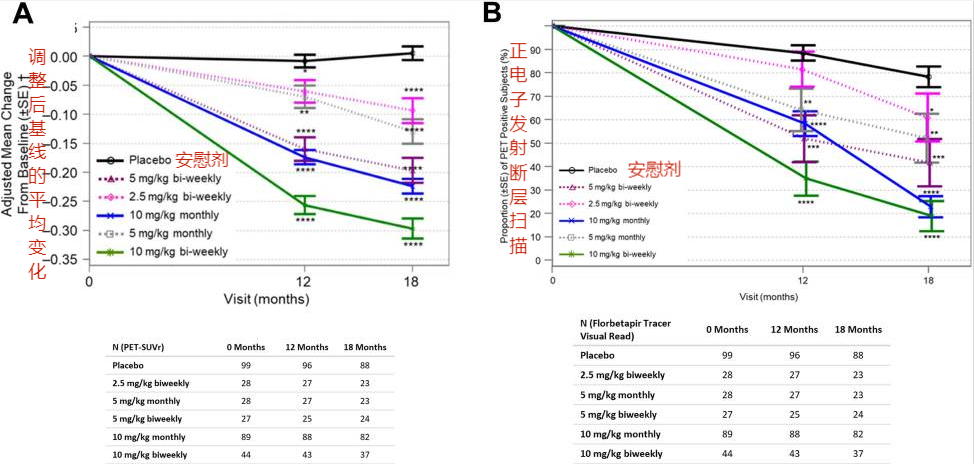
图1:脑淀粉样蛋白的减少相较于基线的变化
结果表明,相较于安慰剂,仑卡奈单抗明显减少了阿尔茨海默病患者的脑淀粉样蛋白,并在18个月的治疗期间显示出双周一次10mg / kg给药方案的早期和持续的活性,疗效显著!
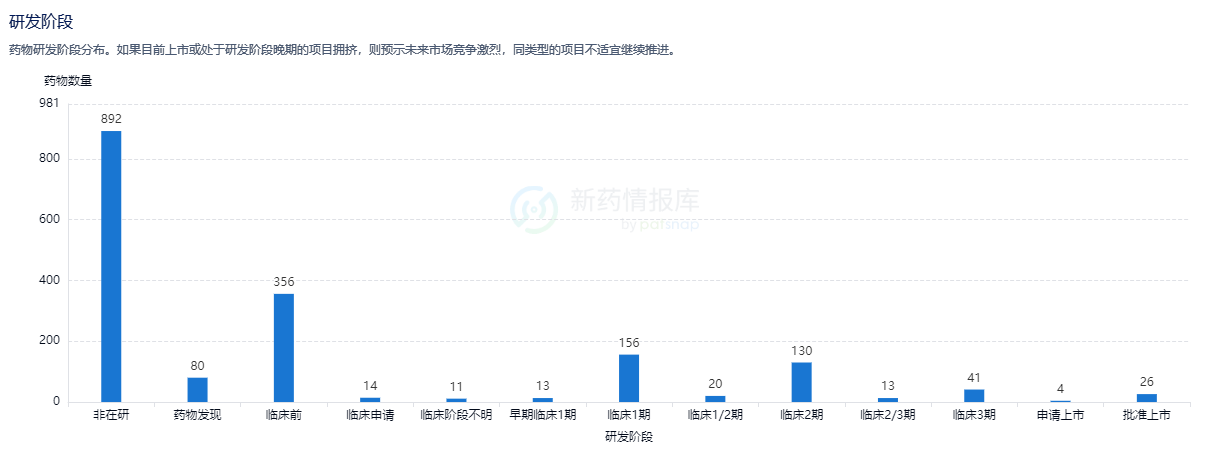
目前针对阿尔茨海默病的药物,除了已上市的LEQEMBI外,还有1566种药物,目前处于非在研阶段的药物有892种,临床前阶段的有356种,药物发现阶段的有80种药物,处于临床申请阶段的有14种,临床阶段不明的有11种,处于早期临床1期阶段的有13种药物,临床1期阶段的有156种药物,临床1/2期阶段的有20种,临床2期的有130种,临床2/3期阶段的有13种,临床3期的目前有41种,申请上市的有4种,相信在不久的将来就会与我们见面,此外还有25种已出现在大家面前的药物,今天就为大家简单介绍两种:
盐酸多奈哌齐
盐酸多奈哌齐于1996年11月25日获美国食品药品管理局 (FDA) 批准上市,用于治疗阿尔茨海默病。
本品通过抑制乙酰胆碱酯酶活性,使突触间隙乙酰胆碱(ACh)的分解减慢,从而提高ACh的含量,改善阿尔茨海默病患者的认知功能。且其抑制乙酰胆碱酯酶活性的强度是抑制丁酰胆碱酯酶的570倍,具有较高的选择性。口服10mg/kg可对脑内胆碱酯酶产生抑制作用,且呈剂量效应关系。
氢溴酸加兰他敏
氢溴酸加兰他敏于2000年7月被欧盟批准后在英国、爱尔兰首次上市,2001年获美国FDA许可用于治疗阿尔茨海默症,现已在25个国家上市。
此药为抗胆碱酯酶药,有较弱的抗胆碱酯酶作用,能透过血脑屏障,故对中枢神经系统作用比较强,临床主要用于治疗阿尔茨海默病、脊髓灰质炎后遗症等,也可用于儿童脑型麻痹、外伤性感觉运动障碍、多发性神经炎及脊神经根炎等。
“今天的申请对于阿尔茨海默病患者来说是一个重要的里程碑,展示了科学和医学界在抗击这种可怕疾病的斗争中的韧性,尽管他们面临许多挫折和挑战,”Biogen总裁兼首席执行官Christopher A. Viehbacher说,“我们赞扬卫材在lecanemab开发方面的领导作用,以及他们能够完成这份申请的速度,这是基于关键的后期Clarity AD研究的重要新数据。”

Biogen总裁兼首席执行官Christopher A. Viehbacher图片,图片来自Gooogle,侵权删
[1]Swanson CJ, Zhang Y, Dhadda S, Wang J, Kaplow J, Lai RYK, Lannfelt L, Bradley H, Rabe M, Koyama A, Reyderman L, Berry DA, Berry S, Gordon R, Kramer LD, Cummings JL. A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer's disease with lecanemab, an anti-Aβ protofibril antibody. Alzheimers Res Ther. 2021 Apr 17;13(1):80. doi: 10.1186/s13195-021-00813-8. Erratum in: Alzheimers Res Ther. 2022 May 21;14(1):70. PMID: 33865446; PMCID: PMC8053280.
[2]Burns A, Iliffe S. Alzheimer's disease. BMJ. 2009;338(feb05 1):b158. doi: 10.1136/bmj.b158.
[3]Dubois B, Feldman HH, Jacova C, Cummings JL, DeKosky ST, Barberger-Gateau P, Delacourte A, Frisoni G, Fox NC, Galasko D, Gauthier S, Hampel H, Jicha GA, Meguro K, O'Brien J, Pasquier F, Robert P, Rossor M, Salloway S, Sarazin M, de Souza LC, Stern Y, Visser PJ, Scheltens P. Revising the definition of Alzheimer’s disease: a new lexicon. Lancet Neurol. 2010;9(11):1118–1127. doi: 10.1016/S1474-4422(10)70223-4.
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
