



皮肤鳞状细胞癌是皮肤癌的一种,是全球第二常见的非黑色素瘤皮肤癌,仅次于基底细胞癌。继Cemiplimab(西米单抗)之后,新型PD-1单抗Cosibelimab(柯希利单抗)潜力巨大。
作为一项正在进行的1期研究(NCT03212404)的一部分,抗PD-L1,全人源单克隆抗体cosibelimab(柯希利单抗 ,以前称CK-301)将在转移性皮肤鳞状细胞癌(CSCC)患者队列中进行检测。此前,在2020年1月,FDA确认了该药物在转移性CSCC患者中的检查注册提交路径;2021年5月,注册完成。
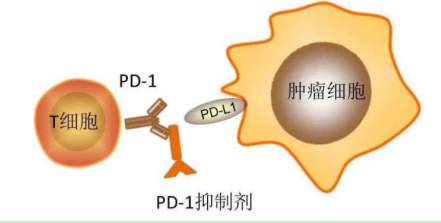
Cosibelimab(柯希利单抗)是一种IgG1单克隆抗体亚型,可与PD-L1结合,并阻断其与PD-1和B7.1的相互作用,从而诱导抗肿瘤反应。此外,cosibelimab(柯希利单抗)与目前市场上的PD-1和PD-L1抗体存在潜在的差异,其持续的靶向肿瘤占有率超过99%,这使得cosibelimab(柯希利单抗)能够重新激活抗肿瘤免疫反应。该制剂还具功能性Fc结构域的优点,能够诱导抗体依赖性、细胞介导的细胞毒性,从而对某些肿瘤类型产生更强的疗效。
2020年SITC年会上分享的关于cosibelimab(柯希利单抗)治疗非小细胞肺癌和皮肤鳞状细胞癌患者的中期数据显示,该药物在这两个患者亚群中都产生了持久和稳健的反应。特别是在局部晚期或转移性皮肤鳞状细胞癌患者中,客观缓解率(ORR)为51.1%。在24例有缓解的患者中,5例获得完全缓解,19例获得部分缓解。83%的患者持续缓解。
在非小细胞肺癌组,客观缓解率(ORR)为44.0%,中位缓解持续时间(DOR)为15.3个月,中位无进展生存期(PFS)为10.3个月。
CSCC(皮肤鳞状细胞癌)队列的研究结果预计将于2021年第四季度公布。如果检测结果为阳性,Checkpoint Therapeutics, Inc.计划在2022年上半年向FDA提交该药物的生物制剂许可申请;该公司还会提交一份欧洲代理的销售授权申请。
参考资料:
Checkpoint Therapeutics announces completion of enrollment in the registration-enabling trial of cosibelimab in metastatic cutaneous squamous cell carcinoma. News release. Checkpoint Therapeutics, Inc. May 12, 2021. Accessed May 17, 2021. https://bit.ly/33VbpbC
Phase 1 study of CK-301 (cosibelimab) as a single agent in subjects with advanced cancers. ClinicalTrials.gov. Updated March 16, 2021. Accessed May 17, 2021. https://clinicaltrials.gov/ct2/show/NCT03212404
Harris DL, Brungs D, Ladwa R, et al. Cosibelimab, an anti-PD-L1 antibody: preliminary safety and efficacy results from a global, multicohort phase 1 clinical trial. Journal for ImmunoTherapy of Cancer. 2020;8. doi:10.1136/jitc-2020-SITC2020.0399
Clingan PR, Brungs D, Ladwa R, et al. Cosibelimab, an anti-PD-L1 antibody in metastatic cutaneous squamous cell carcinoma (CSCC): preliminary safety and efficacy results from a phase 1 clinical trial. Ann Oncol. 2020;31(suppl 4):S736. doi:10.1016/j.annonc.2020.08.1208
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
