免疫药物和靶向药物是两种新兴的抗癌药物。目前市场上有数十种靶向药物和数种免疫药物,已经成为诸多癌症类型的主流治疗方案。更多的新药正在进行临床试验,并将于近期上市。很多患者问:“靶向药和免疫药哪个更适合我?”这个问题无法回答。因为它们不是同一种药物,没有可比性,也无法进行简单替换。就像细菌性感冒的治疗药物,病毒性感冒患者就不适用。因此,有的人适合靶向药物,有的人适合免疫药物,有的人两者都适合。既然二者无法相互替代,那靶向药物与免疫药物有什么区别呢?免疫药物和靶向药物在临床的应用中是怎样的状况?在进行免疫治疗和靶向治疗前应该做哪些特殊检查或者检测呢?下面就这一系列的问题进行详细阐述。
一、免疫药物与靶向药物究竟有何不同?
作用的靶细胞不同
靶向药物针对癌细胞的特定靶点,一般为特定的基因突变。靶向药物和化疗都旨在直接杀死尽可能多的癌细胞。但是相比化疗,靶向药物不会对正常细胞造成重大伤害,因此它的副作用较少。例如,针对白血病的靶向药物和免疫抑制剂是两类新的抗癌药物,靶向药物和化疗都旨在直接杀死尽可能多的癌细胞。理论上,靶向药物可以代替化疗,抑制癌细胞,而不会对正常细胞造成重大伤害。典型的例子是格列卫治疗白血病(Bcr-Abl 突变)和易瑞沙治疗肺癌(EGFR突变)。免疫药物的逻辑与传统药物不同。它对癌细胞不起作用,而是对免疫细胞起作用。这些药物不是杀死癌细胞本身,而是激活针对癌细胞的免疫系统,然后将大量活跃的免疫细胞转化为真正的抗癌武器来完成这项工作。
副作用不同
任何一个药物都会有副作用。由于免疫药物与靶向药物的作用机制不同,因此二者的副作用大不相同。靶向药物往往针对对肿瘤组织生长环境具有重要作用的蛋白质,通常是癌细胞生长的重要食物。靶向药物通过有效抑这些蛋白质的活性来“饿死”癌细胞。与此同时,靶向药物也会“饿死”一些正常细胞,从而引起副作用,类似于化疗。比如针对肺癌的EGFR靶向药易瑞沙,其对表皮细胞有副作用,因此患者使用存在出现皮疹的风险。免疫药物是通过激活免疫细胞来发挥抗癌作用。但它也有副作用,并非没有风险。被激活的免疫细胞不仅可以攻击癌细胞,还可以攻击自身的正常细胞,会导致暂时性的“自身免疫性疾病”。如果很严重,可能会致命。典型的副作用是由主动免疫系统引起的皮疹、肠炎、腹泻和肝损伤。它们的临床特点与化疗或靶向治疗有很大不同,控制这种副作用所需的药物也有所不同。
起效速度不同
靶向药物往往更快,因为它们直接杀死癌细胞。如果有效,通常在几周内,甚至几天内可以看到肿瘤体积缩小,或者肿瘤标记物减少。例如,易瑞沙的平均起效时间为6周,病人通常在第一次复查时,便能知道它是否有效。相较而言,免疫药物的起效时间要慢得多也更复杂。免疫药物通过激活免疫系统而间接杀死癌细胞,存在很多不可控因素。很多病人即便已经服用免疫药物数个月,也不能完全确定它是否有效。
长期和短期效果不同
如果靶向药物在合适的患者身上应用,则有效率高,见效快,在一定时间内可以显著提高患者生活质量和生存率。但由于肿瘤的异质性和进化性,一段时间后几乎无一例外会出现耐药性,需要换药,患者很少长期存活或治愈。目前免疫治疗最大的问题是有效率不高,只有10%-20%(部分肿瘤类型除外),但免疫治疗的优势在于如果患者有反应可能长期受益:少数患者长期存活甚至治愈。
准确性不同
经过多年的研究,靶向药物的使用原理越来越清晰,通常是携带特定基因突变的肿瘤。许多靶向药物的使用被认为是“精确的”。但对于免疫药物来说,预测疗效是困难的,对大量人群进行盲法试验,通常只有10% 的成功率。然而,预测免疫疗法的疗效可能是目前最热门的领域之一,一些突破已经取得,编者相信免疫疗法最终将进入“精准医学”类别。
总之,靶向药物和免疫药物存在很大区别,关键是认清每类药物的特点,根据自身的情况来选择合适的药物。
二、免疫药物的临床应用
从后线治疗到一线治疗, 从晚期肿瘤到早中期肿瘤, 免疫检查点抑制剂在多种实体瘤, 如非小细胞肺癌、胃癌、食管癌、头颈部鳞癌等瘤种中表现出了良好的抗肿瘤疗效, 为许多患者带来了生存的获益, 甚至是长期生存, 改写了多个肿瘤的治疗指南。
1.单药治疗
1.1晚期非小细胞肺癌
在晚期非小细胞肺癌中,PD-1抗体nivolumab最先获得成功。其Ⅰ期扩展研究CA209-003的非小细胞肺癌队列中, 使用免疫治疗的疗效优于历史化疗的总数据。此后,nivolumab的两项大型Ⅲ期临床试验研究表明, 使用nivolumab二线或三线治疗晚期肺鳞癌和非鳞癌患者, 对比多西他赛化疗组, 均获得了总生存期的延长。 这也使nivolumab获得了FDA治疗晚期非小细胞肺癌的适应症。 而在PD-1抗体pembrolizumab的Ⅰ期扩展试验KEYNOTE-001中, 非小细胞肺癌PD-L1高表达组在二线及以上治疗组的中位缓解时间超过12.5个月, 这一数据帮助pembrolizumab直接获得了FDA的批准。此后研究进一步探究了pembrolizumab在非小细胞肺癌二线及一线PD-L1高表达人群中的应用价值, 并均获得成功。 相比前免疫治疗时代5年生存率仅约5%,免疫治疗的使用, 将晚期非小细胞肺癌的5年生存率提高到23.2%, 即使是既往铂类治疗失败的患者, 5年生存率也达到了15.5%。而后有研究表明,在PD-L1高表达的亚组中, 单药使用PD-L1单抗atezolizumab组有统计学及临床上的获益, 因此, atezolizumab在2020年被FDA批准用于转移性非小细胞肺癌PD-L1高表达人群的一线单药治疗。在Ⅲ期不可切的非小细胞肺癌中, PACIFIC研究主要探究了免疫治疗在维持治疗中的地位。在同步放化疗后,接受PD-L1单抗durvalumab巩固治疗组的总生存期提高了18.4个月,目前durvalumab也已成为Ⅲ期不可切非小细胞肺癌同步放化疗后的标准治疗。
1.2晚期肠癌
既往晚期肠癌一线标准治疗为靶向联合化疗。而在MSI-H/dMMR的病人中,这一标准已经被改写。根据研究数据,与传统标准治疗相比,PD-1单抗pembrolizumab单药治疗此类病人,PFS从8.2个月提高到了16.5个月,有近1倍的延长。这一结果有着里程碑式的意义。由于MSI-H/dMMR这一分子特征对于抗PD-1治疗的显著获益,目前FDA已批准PD-1单抗pembrolizumab用于既往标准治疗后疾病进展、无满意替代治疗方案的MSI-H/dMMR晚期或转移性实体瘤患者的治疗。
1.3其他肿瘤
免疫治疗单药的探索早期多集中于二线或三线的治疗,PD-1单抗pembrolizumab的众多临床试验分别证实了其在二线或二线以上肝癌、尿路上皮癌、胃与胃食管连接部腺癌、食管鳞癌中的应用价值。随着目前免疫治疗在各实体瘤中的临床试验结果不断被公布,越来越多新的适应症逐渐获批,而且适应症逐渐从后线推到一线,并逐渐进入辅助治疗和新辅助治疗领域。例如,有研究证实了复发转移性头颈部鳞癌中PDL1阳性的人群可以从pembrolizumab单药治疗中获益,且食管癌术后辅助治疗使用nivolumab可比安慰剂降低31%的死亡风险。
2.代表性的免疫治疗药物
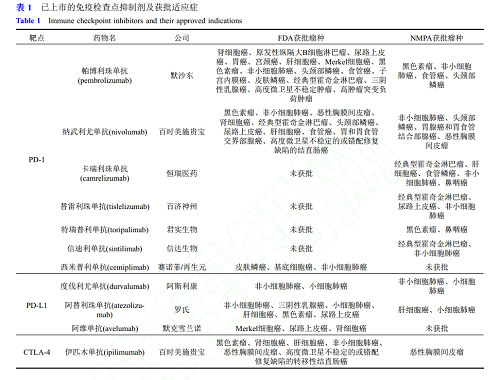
目前已上市的免疫检查点抑制剂及获批适应症详见表1。
三、靶向药物的临床应用
《自然》杂志在评述靶向治疗时说,“致癌基因的发现让我们能够研发出一种‘激光制导’的治疗方法——瞄准导致肿瘤细胞生长失控的基因靶点,集中火力进行致命打击。”因此,与传统化疗药物相比,分子靶向治疗具有高选择性和低毒性,可以长期用药,从而可以在延长患者生存时间的基础上同时改善生活质量。
1单药治疗
1.1胃肠间质瘤
靶向治疗在复发转移/不可切除、拟行术前治疗或需接受术后辅助治疗的胃肠间质瘤(gastrointestinal stromal tumor, GIST)患者中均发挥重要作用。在行靶向治疗前,GIST患者均应行基因检测指导治疗。对于复发转移/不可切除的GIST患者,一线治疗一般推荐伊马替尼400 mg·d-1;但对于 KIT 基因第9号外显子突变的晚期 GIST患者推荐伊马替尼高剂量(600~800 mg·d-1)治疗;复发转移/不可切除GIST患者可选择阿伐替尼。伊马替尼治疗失败的晚期GIST患者建议换用舒尼替尼或伊马替尼加量。瑞戈非尼可用于伊马替尼和舒尼替尼治疗失败后的三线治疗;瑞派替尼可用于晚期GIST的四线及以上治疗。对于拟行术前治疗的GIST患者,可根据基因检测结果选择伊马替尼或阿伐替尼。完整切除术后 PDGFRA基因外显子18 D842V突变的GIST患者对伊马替尼原发耐药,其他突变类型患者行伊马替尼400 mg·d-1治疗。
1.2肝细胞癌
索拉非尼是自2007年美国FDA批准后近10年间唯一被证实可延长肝细胞癌(HCC)患者总生存时间的靶向药物,其靶向治疗HCC分子机制主要体现在:抑制肿瘤细胞的增殖,作为酪氨酸激酶抑制剂下调Raf/MEK/ERK通路,从而抑制肿瘤的增殖;抑制血管生成:通过抑制VEGF受体(VEGF)1~3及血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)β抑制血管生成。在一项多中心、Ⅲ期、双盲研究中,对602例未接受过系统性治疗的HCC患者分别予以索拉非尼和安慰剂治疗,发现索拉非尼组的中位生存期(median overall survival,mOS)和中位疾病进展时间(median time to progression,mTTP)比安慰剂组延长了近3个月。而另一项大型国际随机对照临床试验对226例既往未接受过系统治疗且肝功能Child-Puagh A级的HCC患者分别予以索拉非尼和安慰剂治疗,发现索拉非尼组mOS为6.5个月,较安慰剂组延长了2.3个月;索拉非尼组mTTP为2.8个月,较安慰剂组延长了1倍。索拉非尼是国内外公认的HCC一线治疗药物,但由于其严重不良反应而影响临床疗效和应用。索拉非尼拉开了HCC分子靶向治疗的序幕,在HCC分子靶向治疗领域具有“里程碑”意义。
2.代表性的靶向治疗药物

四、免疫治疗与靶向治疗前的特殊检查
肿瘤PD-L1通路是常用的标志物之一。PD-L1染色是指利用特异性抗体检测肿瘤组织PD-L1蛋白的表达。目前主流的理论认为,部分肿瘤细胞通过表达PD-L1蛋白,与免疫细胞上的PD-1蛋白受体结合,从而抑制免疫细胞的攻击。PD-1抑制剂的作用,是阻断PD-L1和PD-1的结合,从而激活免疫细胞,特别是T淋巴细胞,以发动对肿瘤细胞的攻击。那么在使用免疫治疗药物之前,是否需要进行基因检测?
首先,这取决于肿瘤类型。有些肿瘤患者的预后与PD-L1水平有关,比如黑色素瘤,它与紫外线损伤有关。但其他的则相关性相对较低,比如典型霍奇金淋巴瘤,由于它的总体表现比较高,故无需行基因检测。
其次,这取决于一线治疗还是二线治疗。对于肺癌,可以考虑单独使用一线免疫疗法,因为研究发现PD-L1强阳性(> 50%)的患者获益最大。但目前不推荐二线治疗。一方面,有研究表明PD-L1阴性的病人也可提高生存期。另一方面,由于有效的二线治疗方案选择性低,且化疗的疗效也不佳,因此用PD-L1进行选择的价值有限。
第三,要看是单独使用免疫药物还是联合使用。在肺癌一线临床试验中,如果在一线单独使用PD-1抑制剂类药物,PD-L1阴性患者很难获益,因此做检测很有价值。但是,当免疫药物联合化疗在一线使用时,即使是阴性患者也能获益,因此无需检测。
第四,取决于医院。虽然PD-L1的检测相对较快,但通常需要20多个步骤的人工操作。目前,我国大多数医院的病理科尚未建立稳定的PD-L1染色质质量控制体系,因此PD-L1的检测意义因医院而异。
第五,要看患者的经济情况。任何检测,无论是PD-L1、肿瘤突变负荷还是免疫指标,都需要较大开销。在中国,O药和K药的定价都是全球最低的(每月2万左右)。在经济条件允许和其他选择不理想的情况下,对免疫斑点抑制剂药物进行一段时间的盲测是非常现实的选择。
五、总结与展望
近十年免疫药物与靶向药物在临床实践中的成功,改写了肿瘤治疗的模式,在肿瘤治疗中有划时代的意义。然而,目前在免疫治疗与靶向治疗的实践中,尚有许多未被解决的问题。寻找真正有价值的生物标志物对免疫治疗与靶向治疗筛选合适人群、实现个体化治疗具有重要意义。随着人们对肿瘤微环境研究地深入,相信会有更精准的生物标志物被应用于临床。
参考文献 1 Linsley P S, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med, 1991, 174: 561–569 2 Riley J L, Mao M, Kobayashi S, et al. Modulation of TCR-induced transcriptional profiles by ligation of CD28, ICOS, and CTLA-4 receptors. Proc Natl Acad Sci USA, 2002, 99: 11790–11795 3 Schneider H, Downey J, Smith A, et al. Reversal of the TCR stop signal by CTLA-4. Science, 2006, 313: 1972–1975 4 Waterhouse P, Penninger J M, Timms E, et al. Lymphoproliferative disorders with early lethality in mice deficient in CTLA-4. Science, 1995, 中国科学: 生命科学 7270: 985–988 5 Tivol E A, Borriello F, Schweitzer A N, et al. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity, 1995, 3: 541–547 6 van Elsas A, Hurwitz A A, Allison J P. Combination immunotherapy of B16 melanoma using anti-cytotoxic T lymphocyte-associated antigen 4 (CTLA-4) and granulocyte/macrophage colony-stimulating factor (GM-CSF)-producing vaccines induces rejection of subcutaneous and metastatic tumors accompanied by autoimmune depigmentation. J Exp Med, 1999, 190: 355–366 7 Leach D R, Krummel M F, Allison J P. Enhancement of antitumor immunity by CTLA-4 blockade. Science, 1996, 271: 1734–1736
注:版权声明,本网站所有注明来源”医伴旅”的文字、图片和视频资料,版权均属于医伴旅网站所有,未经授权,任何媒体、网站或个人不得进行转载,否则将追究其法律责任。在取得书面授权转载时,须注明来源“医伴旅”,本网站所转载的文章目的是信息的传递,转载内容不代表本站立场。如有涉及请与我网站联系,进行删除。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。