



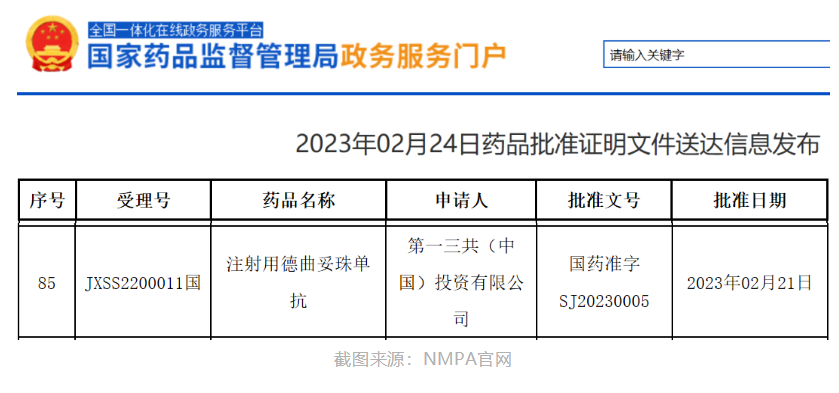
注射用德曲妥珠单抗已正式在中国获批上市,中国国家药品监督管理局(NMPA)批准时间是2023年2月21日。注射用德曲妥珠单抗,国内也称作优赫得,英文名:Enhertu,DS8201,Trastuzumab deruxtecan,T-DXd,通用名:德曲妥珠单抗,是由阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合开发的,德曲妥珠单抗的适应症是单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
3期临床试验DESTINY-Breast03是本次获批的依据,这是一项随机、开放、注册全球3期临床试验,旨在头对头评估德曲妥珠单抗相较于恩美曲妥珠单抗(靶向HER2的ADC)治疗HER2阳性、既往接受过曲妥珠单抗和紫杉类药物治疗的不可切除和/或转移性乳腺癌患者的安全性和有效性。DESTINY-Breast03研究数据显示,在既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性不可切除和/或转移性乳腺癌患者中,与恩美曲妥珠单抗相比,德曲妥珠单抗将患者的疾病进展或死亡风险降低了72%。
在DESTINY-Breast03试验的关键次要终点OS(总生存期)分析中,与恩美曲妥珠单抗组相比,德曲妥珠单抗将患者的死亡风险降低了36%;德曲妥珠单抗组的两年生存率为77.4%,而恩美曲妥珠单抗组则为69.9%;
德曲妥珠单抗组患者的中位PFS(无进展生存期)为28.8个月,比恩美曲妥珠单抗组(6.8个月)延长了22个月;德曲妥珠单抗组确认的客观反应率(ORR)为78.5%(其中21.1%的患者达到完全缓解),而恩美曲妥珠单抗组的ORR为35.0%(其中9.5%的患者达到完全缓解);德曲妥珠单抗组的中位持续缓解时间(DoR)为36.6个月,也高于恩美曲妥珠单抗组的23.8个月;
安全性方面,在DESTINY-Breast03试验中观察到的德曲妥珠单抗的安全性与之前的临床试验一致,没有发现新的安全性信号。
相关热文推荐:德鲁替康(DS8201)靶向药2023价格多少钱一支?
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
