tislelizumab(替雷利珠单抗,BGB-A317)是一种人源化IgG4抗PD-1单克隆抗体,经过特殊设计,可最大限度地减少与巨噬细胞上FcγR 的结合,从而消除抗体依赖的吞噬作用(ADCP效应),这可能是减少T细胞耗竭和抗PD-1治疗耐药性的潜在机制。2019年国家药品监督管理局(NMPA)批准上市。

在一项中国开展的开放标签、多中心II期试验(NCT03469557)中,tislelizumab和化疗的联合治疗显示出持久的疗效,并且在G/GEJ腺癌或食管鳞状细胞癌(ESCC)患者中普遍耐受良好。结果显示:G/GEJ腺癌队列和ESCC队列的中位无进展生存期分别为6.1个月和10.4个月。G/GEJ腺癌队列中,6个月总生存率为85%,12个月总生存率为62%;ESCC队列中,6个月总生存率为71%,12个月总生存率为50%。
医伴旅了解到目前正在开展替雷利珠单抗对比安慰剂联合同步放化疗用于局限性食管鳞状细胞癌的临床试验,符合临床项目报名标准的患者可以踊跃报名,我们将为大家提供最适合的临床项目。
试验药物: BGB-A317注射液
适应症: 局限性食管鳞状细胞癌
临床试验信息: 试验分类:安全性和有效性 试验目的:盲态独立评审委员会(BIRC)根据实体瘤疗效评价标准(RECIST)1.1版(v1.1)评估,比较替雷利珠单抗联合同步放化疗与安慰剂联合同步放化疗在意向治疗(ITT)分析集中的无进展生存期。 试验分期:III期 设计类型:平行分组 随机化:随机化 盲法:双盲 试验范围:国内试验 年龄:18岁(最小年龄)至 75岁(最大年龄) 性别:男+女 健康受试者:无
主要入选标准: 1.签署知情同意书时年龄介于18至75岁之间 2.经组织学确诊为局限性ESCC 3.存在符合RECIST v1.1定义的可测量和/或不可测量病灶 4.ECOG体能状态≤1 5.器官功能良好
主要排除标准: 1.有重度营养不良的指征 2.存在临床上未控制的、需要反复引流或医疗干预(在随机分组前2周内)的胸腔积液、心包积液或腹水 3.已知对试验方案中指定的化疗不耐受或耐药 4.曾接受过放疗、或抗PD-1、PD-L1、PD-L2治疗或其他肿瘤免疫治疗 5.有活动性自身免疫性疾病或者有自身免疫性疾病史但可能复发的患者
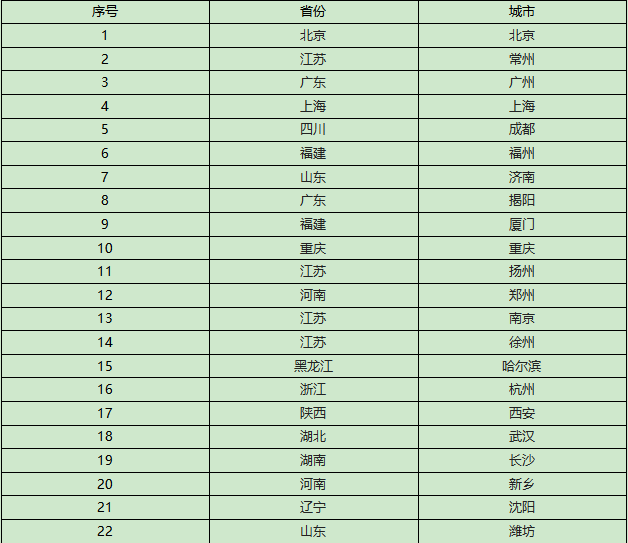
主要研究中心所在地(具体启动情况以后期咨询为准):

联系方式:
如果您身边有合适的患者欢迎与我们联系。24小时服务热线:400-001-2811

参与临床试验,不仅可以使用最新的治疗方法,医生还会密切关注您的病情状况。病情严重的患者,现行疗法效果不佳或者无力承担费用,参加临床试验免费尝试新的治疗方法,不管是对患者本人还是家属都是一种不错的选择。欢迎大家踊跃报名。注:最终能否入选需要由研究医生判定。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。