帕博利珠单抗(Pembrolizumab,商品名:可瑞达,俗称“K药”),2019年,卫材(Eisai)与默沙东(Merck & Co)联合宣布,美国FDA批准用于治疗晚期子宫内膜癌患者的“仑伐替尼+帕博利珠单抗”组合疗法。
免疫联合靶向治疗晚期子宫内膜癌,可以说是打破了传统治疗方式。关于Ib/II期、开放标签、单臂KEYNOTE-146/Study111试验的研究结果:对于非MSI-H/dMMR肿瘤的患者,客观缓解率为38.3%,完全缓解率为10.6%, 27.7%的患者获得部分缓解。69%有缓解的患者的缓解持续时间达到至少6个月。这种新治疗组合可以有效延长患者的生存期和客观缓解率,对于晚期子宫内膜癌患者来说,是一种新的希望和选择。
医伴旅了解到目前正在开展帕博利珠单抗联合仑伐替尼用于治疗子宫内膜癌的III期研究,符合临床项目报名标准的患者可以踊跃报名,我们将为大家提供最适合的临床项目。
试验药物: 帕博利珠单抗注射液
适应症: 帕博利珠单抗联合仑伐替尼用于晚期或复发性子宫内膜癌的一线治疗
临床试验信息: 试验分类:安全性和有效性 试验目的:在使用帕博利珠单抗联合仑伐替尼对比化疗治疗III期、IV期或复发性子宫内膜癌的女性患者中,对pMMR受试者和所有受试者进行的主要终点为无进展生存期(PFS)和总生存期(OS)的研究。 试验分期:III期 设计类型:平行分组 随机化:随机化 盲法:开放 试验范围:国际多中心试验 年龄:18岁(最小年龄)至 无岁(最大年龄) 性别:女 健康受试者:无
主要入选标准: 1.患有经组织学证实的III期、IV期或复发性子宫内膜癌,伴有BICR根据RECIST 1.1评估的可测量病灶或不可测量但在影像学上明显的疾病。 2.已提供存档肿瘤组织样本或新获得的既往未进行过辐照的肿瘤病灶粗针活检或切除活检组织,用于测定MMR状态。 3.在研究治疗首次给药前7天内评估的ECOG体能状态评分为0或1分。 4.在签署知情同意书当天年满18岁的女性。 5.受试者(或法定代表,如适用)提供参加研究的知情同意书 6.在采用或不采用抗高血压药物的情况下BP控制充分,定义为BP≤150/90 mmHg并且在随机分组之前1周内抗高血压药物保持不变。
主要排除标准: 1.患有癌肉瘤(恶性混合性mullerian肿瘤)、子宫内膜平滑肌肉瘤或其它高等级肉瘤,或子宫内膜间质肉瘤。 2.存在中枢神经系统(CNS)转移的受试者,除非他们已经完成了局部治疗(例如,全脑放射治疗[WBRT]、手术或放射外科治疗),并且在本研究治疗开始前至少4周已经停止使用皮质类固醇治疗这一适应症。在开始研究治疗前,CNS转移的任何体征(如,放射学)或症状都必须稳定至少4周。 3.已知患有另一种恶性肿瘤(子宫内膜癌之外),目前正在进展,或过去3年内接受过有效治疗。 注意:不排除已接受可能根治性治疗的皮肤基底细胞癌、皮肤鳞状细胞癌或原位癌(例如,原位导管癌、原位宫颈癌)。 4.患有胃肠道吸收不良、胃肠道吻合术或任何其他可能影响仑伐替尼吸收的病症。 5.现有≥3级胃肠道或非胃肠道瘘。 6.在随机分组前2周内有临床严重咯血或肿瘤出血。
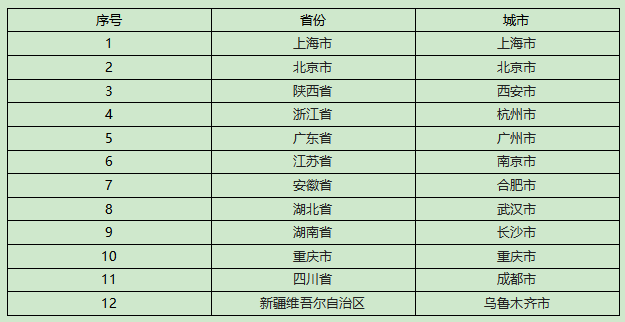
主要研究中心所在地(具体启动情况以后期咨询为准):
联系方式: 如果您身边有合适的患者欢迎与我们联系。24小时服务热线:400-001-2811

参与临床试验,不仅可以使用最新的治疗方法,医生还会密切关注您的病情状况。病情严重的患者,现行疗法效果不佳或者无力承担费用,参加临床试验免费尝试新的治疗方法,不管是对患者本人还是家属都是一种不错的选择。欢迎大家踊跃报名。注:最终能否入选需要由研究医生判定。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。