



试验发现
2期试验(NCT03132636)评估PD-1抑制剂cemiplimab rwlc(Libtayo)的结果,客观缓解率和疾病稳定率持续向好。这种抗肿瘤活性包括转移性基底细胞癌(mBCC)患者在进展或对hedgehog抑制剂不耐受后的持久和安全的缓解。中期结果在癌症免疫治疗学会(SITC 2020)第35届年会和会前项目之前公布。

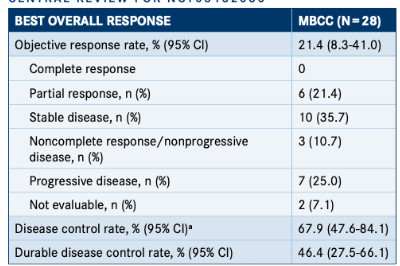
在28例患者中,根据独立中心审查委员会(ICR)的客观缓解率(ORR)为21.4%(n=6;95%CI,8.3%-41.0%),其中包括所有部分缓解率(PRs)。疾病稳定率(SD)为35.7%(n=10),疾病控制率(DCR)为67.9%,定义为首次评估时完全缓解(CR)、PR、SD或非进展性疾病的患者比例(95%CI,47.6%-84.1%)(表)。
“已经有关于服用cemiplimab的病例报告,但这是首次对多数患者进行前瞻性试验。该药物的活性和持久性似乎很有希望。”该试验的主要作者、科罗拉多医学院医学肿瘤学教授Karl Lewis说。
基底细胞癌(Basil cell carcinoma,BCC)是最常见的皮肤癌类型,紫外线照射是一个重要的危险因素。大多数晚期基底细胞癌患者接受治疗性手术。然而,不能接受治疗性手术或放疗的晚期疾病患者也可以进行系统治疗。
维莫德吉(Vismodegib,Erivedge)和索尼德吉(sonidegib,Odomzo)是经批准用于局部晚期或mBCC患者的口服hedgehog抑制剂。然而,没有FDA批准的治疗方案可用于出现病情进展或对hedgehog抑制剂不耐受的患者。
Cemiplimab是在局部晚期和mBCC患者使用hedgehog抑制剂治疗后表现出临床疗效的首个系统疗法。在欧洲肿瘤医学会2020年虚拟大会上首次展示了2期试验的局部晚期试验组结果。
2期试验
2期试验纳入了2个试验组:第1组包括淋巴结和远程mBCC患者,第2组包括局部晚期BCC患者(n=84)。mBCC试验组包括随访约57周的患者,可以提供95%CI的ORR。
患者每3周静脉注射350毫克cemiplimab单抗,持续93周。每9周在第1天至第5天进行肿瘤评估,此后每12周在第6天至第9天进行肿瘤评估。ICR采用RECIST 1.1内脏损害标准或世界卫生组织皮肤损害标准对肿瘤反应评估。
据ICR的规定,ORR作为试验的主要终点。次要终点包括研究人员评价的ORR、无进展生存率(PFS)、ICR和研究人员评价的PFS、总生存率、ICR规定的CR率以及cemiplimab的安全性和耐受性。
在mBCC试验组的既往治疗方面,100%的患者接受维莫德吉(n=28),10.7%(n=3)接受索尼德吉,10.7%(n=3)接受维莫德吉和索尼德吉。中止既往治疗的原因包括使用hedgehog抑制剂治疗后出现疾病进展(75.0%;n=21);主要因使用维莫德吉(39.3%;n=11)与索尼德吉(7.1%;n=2)导致先前出现hedgehog抑制剂耐受性(35.7%;n=10);SD为hedgehog抑制剂治疗9个月后的最佳反应(17.9%;n=5)。
25%的患者(n=7)出现了疾病进展。不到10%的患者(7.1%;n=2)无法评估。
在数据截止时,尚未达到中位缓解持续时间(DOR)。出现缓解的患者的6个月和12个月DOR估计值分别为100%(95%CI,68.3%-97.6%)和66.7%(95%CI,19.5%-90.4%)。
Cemiplimab的安全性与之前报道的该药物对其他肿瘤类型的安全性一致。78.6%的患者(n=22)出现任何级别的与治疗相关的不良反应(TRAEs)。17.9%的患者(n=5)出现3级或更高级别的不良反应,1例因葡萄球菌肺炎死亡,确定与试验治疗无关。
最常见的症状是疲劳(25%;n=21)、瘙痒(14%;n=12)和乏力(14%;n=12)。最常见的3级或更高级别的TRAE是疲劳(2%;n=2)、结肠炎(2%;n=2)和自身免疫性结肠炎(2%;n=2)。14名患者(17%)因任何级别的TRAE而中止治疗。
先前提出的局部晚期BCC试验组研究结果显示,服用cemiplimab的患者的ORR为31.0%(95%CI,21.3%-42.0%),其中包括6%的CR率(n=5)和25.0%的PR率(n=21)。此外,只有不到一半的患者(48.8%;n=41)达到SD。
在局部晚期试验组中,在数据截止时未达到中位DOR。6个月和12个月的DOR率分别为90.9%(95%CI,68.3%-97.6%)和85.2%(95%CI,60.5%-95.0%)。
参考文献:
https://www.targetedonc.com/view/durable-responses-are-observed-with-cemiplimab-in-mbcc
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
