



1、成人斑块型银屑病
四项多中心、随机、双盲、安慰剂对照的皮下可善挺(苏金单抗、司库奇尤单抗)试验(试验PsO1、PsO2、PsO3和PsO4)招募了2403名18岁及以上的PsO患者(691名被随机分配到可善挺(苏金单抗、司库奇尤单抗)300毫克,692名被随机分配到可善挺(苏金单抗、司库奇尤单抗)150毫克,694名被分配到安慰剂,323名被分配到生物活性对照),这些患者的BSA受累最低为10%,银屑病面积和严重程度指数(PASI)评分大于或等于12,并且在这些研究中,每300毫克剂量以150毫克的两次注射给药。
a.试验PsO1 (NCT01365455)招募了738名受试者(245名随机分配至可善挺(苏金单抗、司库奇尤单抗)300毫克,245名随机分配至可善挺(苏金单抗、司库奇尤单抗)150毫克,248名随机分配至安慰剂)。受试者在第0、1、2、3和4周接受皮下治疗,随后每四周给药一次。被随机分配接受安慰剂但在第12周无应答的受试者被交叉分配在第12、13、14、15和16周接受可善挺(苏金单抗、司库奇尤单抗)(300毫克或150毫克),随后每4周接受相同剂量。所有受试者在首次接受试验治疗后均接受了长达52周的随访。
b.试验PsO2 (NCT01358578)招募了1306名受试者(327名随机分配至可善挺(苏金单抗、司库奇尤单抗)300毫克,327名随机分配至可善挺(苏金单抗、司库奇尤单抗)150毫克,326名随机分配至安慰剂,323名随机分配至生物活性对照)。受试者在第0、1、2、3和4周接受皮下治疗,随后每4周给药一次。被随机分配接受安慰剂但在第12周无应答的受试者在第12、13、14、15和16周交叉接受可善挺(苏金单抗、司库奇尤单抗)(300毫克或150毫克),随后每4周接受相同剂量。所有受试者在首次接受试验治疗后均接受了长达52周的随访。
c.试验PsO3 (NCT01555125)招募了177名受试者(59名被随机分配至可善挺(苏金单抗、司库奇尤单抗)300毫克,59名被随机分配至可善挺(苏金单抗、司库奇尤单抗)150毫克,59名被随机分配至安慰剂),并评估了可善挺(苏金单抗、司库奇尤单抗)通过预填充注射器自行给药12周的安全性、耐受性和可用性。受试者在第0、1、2、3和4周接受皮下治疗,随后每4周接受一次相同剂量的治疗,共持续12周。
d.试验PsO4 (NCT01636687)招募了182名受试者(60名随机分配至可善挺(苏金单抗、司库奇尤单抗)300毫克,61名随机分配至可善挺(苏金单抗、司库奇尤单抗)150毫克,61名随机分配至安慰剂),并通过Sensoready笔评估了可善挺(苏金单抗、司库奇尤单抗)自我给药的安全性、耐受性和可用性,为期12周。受试者在第0、1、2、3和4周接受皮下治疗,随后每4周接受一次相同剂量的治疗,共持续12周。
1)端点
在所有试验中,终点为自基线至第12周PASI评分降低至少75% (PASI 75)且研究者2011年修订全球评估(IGA)治疗成功(明确或几乎明确)的受试者比例。其他评估结果包括:根据银屑病症状日记,第12周时PASI评分自基线降低至少90% (PASI 90分)的受试者比例,至第52周时疗效维持,第12周时瘙痒、疼痛和鳞屑改善。
PASI评分是一个综合评分,考虑了受影响的BSA百分比以及受影响区域内银屑病变化的性质和严重程度(硬结、红斑和鳞屑)。IGA是一个5类量表,包括“0 =透明”,“1 =几乎透明”,“2 =轻度”,“3 =中度”或“4 =重度”,表明医生对银屑病严重程度的总体评估侧重于硬结、红斑和鳞屑。“清澈”或“几乎清澈”的治疗成功包括无银屑病体征或病变呈正常至粉红色,无斑块增厚,无至最小局灶性鳞屑。
2)基线疾病特征
在所有治疗组中,基线PASI评分范围为11-72,中位值为20,基线IGA评分范围为“中度”(62%)至“重度”(38%)。在纳入安慰剂对照试验的2077名PsO受试者中,79%为生物幼稚(从未接受过生物制剂的既往治疗),45%为非生物失败(对非生物治疗的既往治疗无反应)。在之前接受过生物制剂治疗的受试者中,超过三分之一为生物失败。大约15%至25%的试验对象有银屑病关节炎病史。
3)临床反应
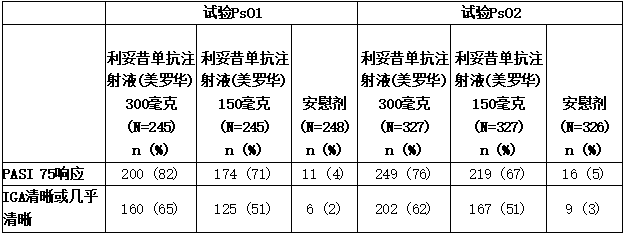
表所示为试验PsO1和PsO2的结果。
表:试验PsO1和PsO2中出现PsO的成人在第12周的临床结果(皮下治疗)
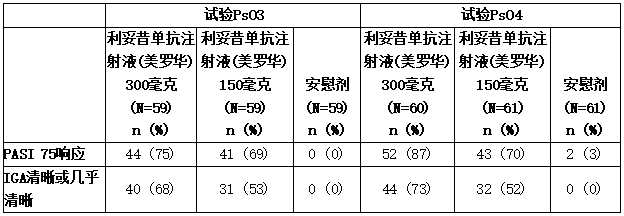
表所示为试验PsO3和PsO4的结果。
表:试验PsO3和PsO4中出现PsO的成人在第12周的临床结果(皮下治疗)
年龄、性别和种族分组检查未发现这些分组之间对可善挺(苏金单抗、司库奇尤单抗)的应答差异。根据中度至重度PsO受试者的事后亚组分析,体重较轻和疾病严重程度较低的受试者使用可善挺(苏金单抗、司库奇尤单抗)150毫克可能达到可接受的应答。
与安慰剂相比,在分别为59% (145/245)和39% (95/245)对1% (3/248)的受试者(试验PsO1)和54% (175/327)和42% (137/327)对2% (5/326)的受试者(试验PsO2)中,可善挺(苏金单抗、司库奇尤单抗)300毫克和150毫克在第12周时实现了PASI 90反应。在试验PsO3和PsO4中也观察到了类似的结果。
a.在持续治疗52周的情况下,试验PsO1中在第12周时为PASI 75响应者的受试者在81% (161/200)接受可善挺(苏金单抗、司库奇尤单抗)300毫克治疗的受试者和72% (126/174)接受可善挺(苏金单抗、司库奇尤单抗)150毫克治疗的受试者中保持其响应。在第12周时IGA曲线清晰或几乎清晰的试验PsO1受试者在接受可善挺(苏金单抗、司库奇尤单抗)300毫克治疗的74% (119/160)受试者和接受可善挺(苏金单抗、司库奇尤单抗)150毫克治疗的59% (74/125)受试者中也保持其应答。
b.类似地,在试验PsO2中,84% (210/249)接受可善挺(苏金单抗、司库奇尤单抗)300毫克治疗的受试者和82% (180/219)接受可善挺(苏金单抗、司库奇尤单抗)150毫克治疗的受试者中,PASI 75应答者保持其应答。在80% (161/202)接受可善挺(苏金单抗、司库奇尤单抗)300毫克治疗的受试者和68% (113/167)接受可善挺(苏金单抗、司库奇尤单抗)150毫克治疗的受试者中,在IGA曲线上清晰或几乎清晰的试验PsO2受试者也保持其应答。
在选择参与患者报告结果评估的受试者(39%)中,使用银屑病症状日记观察到与第12周瘙痒、疼痛和鳞屑相关的体征和症状较安慰剂有所改善(试验PsO1和PsO2)。
4)头皮银屑病皮损
一项随机、安慰剂对照试验(试验PsO5NCT02267135)招募了102名患有中度至重度头皮银屑病病变的受试者,定义为银屑病头皮严重程度指数(PSSI)评分大于或等于12,IGA头皮评分大于或等于3,且至少30%的头皮受到影响。在该试验中,62%的受试者至少50%的头皮表面积受到影响。在本研究中,每300毫克剂量以150毫克的两次注射给药。在可善挺(苏金单抗、司库奇尤单抗)300毫克和安慰剂组中,IGA头皮评分仅为0或1(清晰或几乎清晰)的受试者比例分别为56.9%和5.9%。
5)300毫克/2毫升预充液注射器和300毫克/2毫升UnoReady笔
两项随机、双盲、安慰剂对照、为期52周的试验(PsO6和PsO7)招募了336名至少18岁的中重度PsO受试者,作为全身治疗或光疗的候选对象,以评估可善挺(苏金单抗、司库奇尤单抗)300毫克皮下给药(单个300毫克/2毫升预充式注射器)(试验PsO6,NCT02748863,214名患者)或单个300毫克/2毫升uneady笔(试验PsO7,NCT03589885,214名患者)的安全性和疗效两项试验的共同主要终点是第12周时达到PASI 75°反应和IGA mod 2011“清晰”或“几乎清晰”反应,且自基线至少降低2级的受试者比例。
表:试验PsO6和PsO7中出现PsO的成人在第12周的临床结果(皮下治疗)
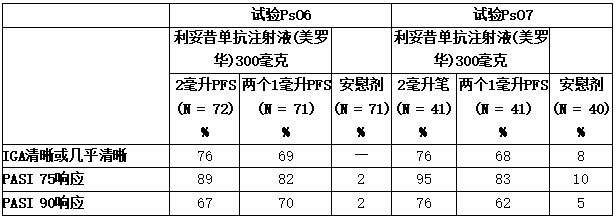
缩写:PFS,预充式注射器。
使用多重估算法估算了缺失数据。
2、小儿斑块型银屑病
一项52周、多中心、随机、双盲、安慰剂和活性药物对照试验(试验PsO8NCT02471144)纳入了162名6岁及以上患有严重斑块型银屑病(定义为PASI评分≥ 20分,2011年修订评分为4分,且涉及≥ 10%的BSA)的儿童受试者,他们是系统性治疗的候选人。
受试者被随机分配接受皮下安慰剂、可善挺(苏金单抗、司库奇尤单抗)或生物活性对照药物治疗。在可善挺(苏金单抗、司库奇尤单抗)组中,体重小于25千克的受试者接受75毫克,体重25至小于50千克的受试者接受75毫克或150毫克(推荐剂量的2倍),体重至少50毫克的受试者接受150毫克或300毫克(推荐剂量的2倍)。在本研究中,每300毫克剂量以150毫克的两次皮下注射给药。可善挺(苏金单抗、司库奇尤单抗)和安慰剂组的受试者在第0、1、2、3和4周接受皮下治疗,随后每4周给药一次。在第12周,被随机分配到安慰剂组的无应答受试者被转换为可善挺(苏金单抗、司库奇尤单抗)(剂量基于体重),并在第12、13、14和15周服用可善挺(苏金单抗、司库奇尤单抗)随后从第16周开始每4周服用相同剂量。
1)基线特征
总体上,60%的受试者为女性,83%为白人,中位体重为50.6千克,平均年龄为13.5岁,23%的受试者年龄小于12岁。基线时,中位PASI评分为26分(范围为17-60分),99%的受试者的IGA修正2011年评分为4分(‘重度’)。约43%的受试者以前接受过光疗,53%接受过常规全身治疗,3%接受过生物制剂治疗,9%伴有银屑病关节炎。
2)端点
共同主要终点是自基线至第12周PASI评分降低至少75% (PASI 75分)的受试者比例,以及自基线至第12周达到IGA修正版2011年评分“清晰”或“几乎清晰”(0或1分,至少改善2分)的受试者比例。关键次要终点是自基线至第12周PASI评分降低至少90% (PASI 90分)的受试者比例。
3)临床反应
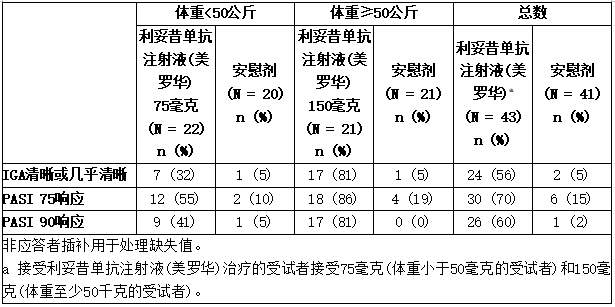
表按基线体重分层列出了试验PsO8中批准剂量的第12周疗效结果。
表:试验PsO8(皮下治疗)中出现严重PsO的儿童受试者第12周的临床结果
3、成人银屑病关节炎
在3项随机、双盲、安慰剂对照试验(PsA1、PsA2和PsA3)中,在1999名患者中对可善挺(苏金单抗、司库奇尤单抗)的安全性和疗效进行了评估,试验对象为18岁及以上患有活动性PsA(大于或等于3个肿胀且大于或等于3个压痛关节),尽管接受了非甾体抗炎药(NSAID)、皮质类固醇或疾病改善类抗风湿药物(DMARD)治疗。这些试验中的患者在所有试验中的PsA诊断为至少5年。
a.PsA1研究(NCT 01752634)评估了397名患者,他们在第0、1、2、3和4周接受了75毫克、150毫克或300毫克可善挺(苏金单抗、司库奇尤单抗)(以150毫克两次皮下注射给药)治疗,之后每4周接受一次相同的皮下给药。根据应答者状态,接受安慰剂的患者在第16周或第24周被重新随机分配接受皮下注射可善挺(苏金单抗、司库奇尤单抗)(每4周150毫克或300毫克)。主要终点是第24周时达到ACR20应答的患者百分比。
b.PsA2研究(NCT 01392326)评估了606名患者,这些患者在第0、2和4周接受了10毫克/千克的可善挺(苏金单抗、司库奇尤单抗)静脉注射或安慰剂治疗,之后每4周接受75毫克或150毫克的皮下可善挺(苏金单抗、司库奇尤单抗)治疗(或安慰剂)。根据应答者状态,接受安慰剂的患者在第16周或第24周被重新随机分配接受皮下注射可善挺(苏金单抗、司库奇尤单抗)(每4周75毫克或150毫克)。
c.PsA3研究(NCT 02404350)评估了996名患者,他们在第0、1、2、3和4周接受了150毫克或300毫克可善挺(苏金单抗、司库奇尤单抗)(以150毫克两次皮下注射给药)治疗,随后每4周接受一次相同的皮下给药,或每4周接受一次可善挺(苏金单抗、司库奇尤单抗)150毫克治疗。根据应答者状态,在第16周或第24周,接受安慰剂治疗的患者按基线随机分配接受皮下注射可善挺(苏金单抗、司库奇尤单抗)(150毫克或300毫克)。主要终点为第16周的ACR20反应,关键次要终点为第24周改良的总夏普评分(mTSS)自基线的变化。
1)基线疾病特征
在基线时,分别有超过61%和42%的患者患有附着炎和指(趾)炎。总体而言,31%的患者因缺乏疗效或不耐受而中止了先前的抗TNFα药物治疗。此外,两项研究中约53%的患者同时使用甲氨蝶呤(MTX)。纳入了不同亚型PsA的患者,包括无类风湿结节证据的多关节关节炎(80%)、不对称外周关节炎(63%)、远端指间受累(58%)、强直性脊柱炎伴外周关节炎(20%)和关节炎缄默症(7%)。
2)临床反应
在PsA1中,与第24周时接受安慰剂治疗的患者相比,接受150毫克或300毫克可善挺(苏金单抗、司库奇尤单抗)治疗的患者表现出更强的临床应答,包括ACR20、ACR50和ACR70(表7)。无论是否合用MTX治疗,患者的反应相似。无论之前是否接触过抗TNFα,均可观察到应答。
在接受可善挺(苏金单抗、司库奇尤单抗)治疗的共存PsO患者(n = 99)中,通过银屑病面积严重程度指数(PASI)测量,与安慰剂相比,治疗后银屑病的皮损改善。
表:第16周和第24周PsA1研究的反应(皮下治疗)
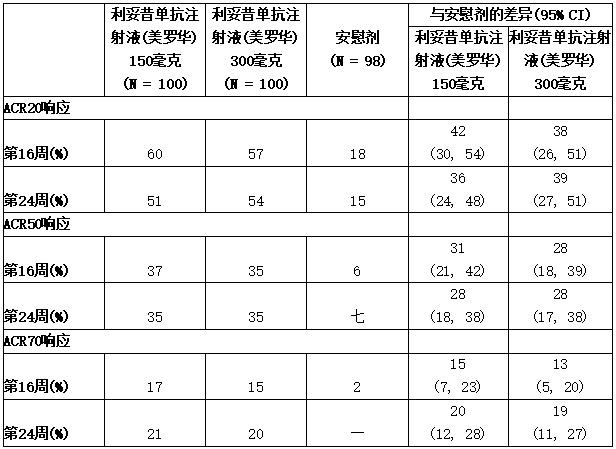
a 第16周时符合逃逸标准(压痛或肿胀关节计数改善不到20%)的患者被视为无应答者。
通过随访达到ACR20应答的患者百分比见图。使用安慰剂的患者在未接受负荷方案的情况下接受了可善挺(苏金单抗、司库奇尤单抗)治疗,随着时间的推移,这些患者获得了相似的ACR20应答(数据未显示)。
图:至第24周(皮下治疗)在PsA1研究中达到ACR 20应答的成人患者百分比
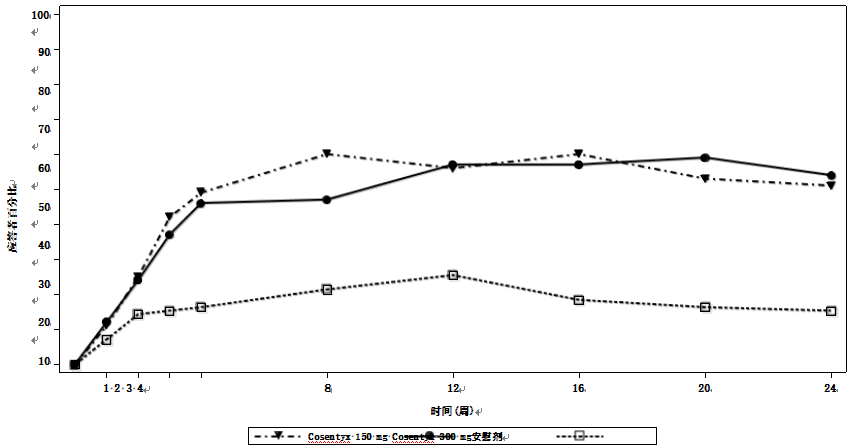
a 第16周时符合逃逸标准(压痛或肿胀关节计数改善不到20%)的患者被视为无应答者。
表显示了PsA1研究中ACR应答标准各组成部分的改善情况。
表:第16a周时ACR组分自基线的平均变化(PsA1研究)(皮下治疗)
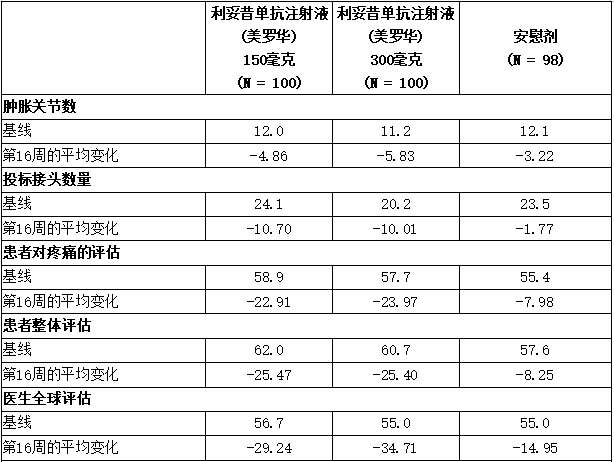
a 显示第16周而非第24周的数据,以提供安慰剂逃逸至可善挺(苏金单抗、司库奇尤单抗)前各研究组之间的比较。
b 根据观察到的数据可能会发生变化。
第24周时,与安慰剂相比,在每一个可善挺(苏金单抗、司库奇尤单抗)组中观察到了末端炎和指(趾)炎评分的改善。
3)射线照相响应
在PsA3研究中,与基线相比,在第24周时对结构损伤进展的抑制进行了放射影像学评估,并以改良mTSS及其组分、侵蚀评分(ES)和关节间隙狭窄评分(JSN)表示。手、腕和足的x光片在基线、第16周和/或第24周获得,并由至少两名不了解治疗组和就诊次数的读者独立评分。与安慰剂治疗相比,皮下注射可善挺(苏金单抗、司库奇尤单抗)150毫克(不含负荷剂量)、150毫克(含负荷剂量)和300毫克(含负荷剂量)治疗显著抑制了外周关节损伤的进展(通过第24周时mTSS自基线的变化测量)。从随机分配到第24周,可善挺(苏金单抗、司库奇尤单抗)150毫克(无负荷剂量,150毫克,300毫克)组无疾病进展(定义为mTSS自基线的变化小于或等于0.0)的患者百分比分别为75.7%、70.9%和76.5%,而安慰剂组为68.2%。
表:改良的总夏普评分每24周的变化率(皮下治疗)
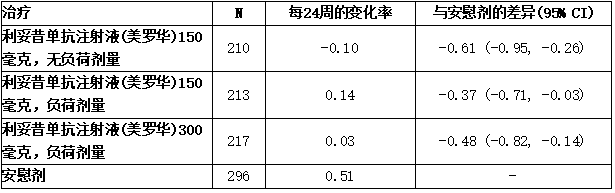
来自线性混合效应模型的结果,该模型排除了在第16周接受逃逸治疗的安慰剂受试者的逃逸后数据。该模型假设随着时间的推移近似呈线性进展,并估计了24周内的进展率(斜率)差异,以比较治疗组。
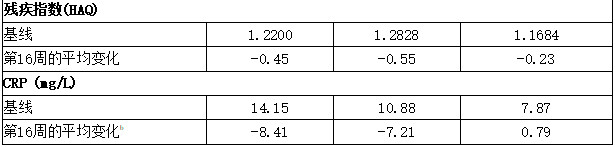
4)实际职能
通过健康评估问卷-残疾指数(HAQ-DI)评估的身体功能改善表明,在第16周和第24周,皮下注射可善挺(苏金单抗、司库奇尤单抗)150毫克和300毫克组中HAQ-DI评分自基线至少改善-0.3的患者比例高于安慰剂组。在PsA1研究的第16周,安慰剂组自基线的估计平均变化为-0.23,而可善挺(苏金单抗、司库奇尤单抗)150毫克组为-0.45,可善挺(苏金单抗、司库奇尤单抗)300毫克组为-0.55。
5)静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗成人活动性银屑病关节炎
静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗成年活性PsA患者的有效性是根据药代动力学暴露在成年活性PsA患者皮下注射可善挺(苏金单抗、司库奇尤单抗)的确定有效性推断出来的。
4、强直性脊柱炎
在三项随机、双盲、安慰剂对照试验(AS1、AS2和AS3)中,对816例活性AS成人患者(18岁及以上)进行了皮下注射可善挺(苏金单抗、司库奇尤单抗)的安全性和疗效评估。尽管接受了非甾体抗炎药(NSAID)、皮质类固醇或疾病改善型抗风湿药物(DMARD)治疗,但患者仍有巴斯强直性脊柱炎疾病活动指数(BASDAI)大于或等于4的活动性疾病。
a.AS1研究(NCT01649375)评估了219名患者,他们在第0、1、2、3和4周接受了75毫克或150毫克的皮下可善挺(苏金单抗、司库奇尤单抗)治疗,之后每4周接受一次相同剂量的治疗。第16周时,接受安慰剂的患者被重新随机分配至每4周皮下注射75毫克或可善挺(苏金单抗、司库奇尤单抗)主要终点是第16周时达到ASAS20应答的患者百分比。
b.AS2研究(NCT01358175)评估了371名患者,这些患者在第0、2和4周(两个治疗组)接受了10毫克/千克的塞克硝唑静脉注射治疗或安慰剂治疗,随后每4周接受75毫克或150毫克的可善挺(苏金单抗、司库奇尤单抗)皮下注射治疗或安慰剂治疗。根据应答者状态,接受安慰剂的患者在第16周或第24周被重新随机分配接受皮下注射可善挺(苏金单抗、司库奇尤单抗)(每4周75毫克或150毫克)。
c.AS3研究(NCT02008916)评估了226名患者,他们在第0、2和4周接受了10毫克/千克的静脉注射塞库单抗(对于两个治疗组)或安慰剂治疗,随后每4周接受150毫克或300毫克的皮下注射可善挺(苏金单抗、司库奇尤单抗)治疗或安慰剂治疗。接受安慰剂的患者被重新随机分配到第16周接受皮下注射可善挺(苏金单抗、司库奇尤单抗)(每4周150毫克或300毫克)。主要终点是在第16周时达到ASAS20应答的患者百分比。直至第52周,患者均不知晓治疗方案,试验持续至第156周。在本研究中,每300毫克剂量以150毫克的两次注射给药。
1)基线疾病特征
基线时,分别有约13%和25%的人同时服用MTX或柳氮磺胺吡啶。总体上,29%的患者因缺乏疗效或不耐受而中断先前的抗TNFα药物治疗。
2)临床反应
在AS1中,与安慰剂治疗的患者相比,接受150毫克可善挺(苏金单抗、司库奇尤单抗)治疗的患者在第16周的ASAS20和ASAS40应答方面表现出更大的改善。无论是否采用联合治疗,患者的反应相似。
表:研究AS1(皮下治疗)中所有AS患者在第16周时的ASAS20和ASAS40应答
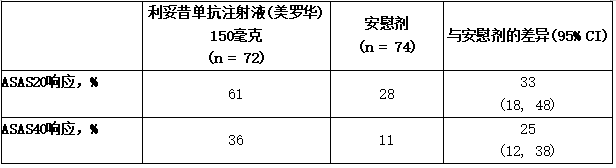
表显示了ASAS20应答标准主要组成部分和其他疾病活动性指标的改善情况。
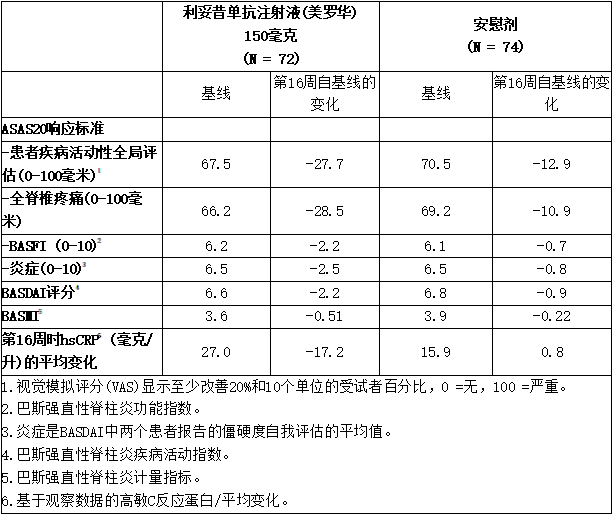
表:第16周ASAS20组分和疾病活动性的其他测量值(AS1研究)(皮下治疗)
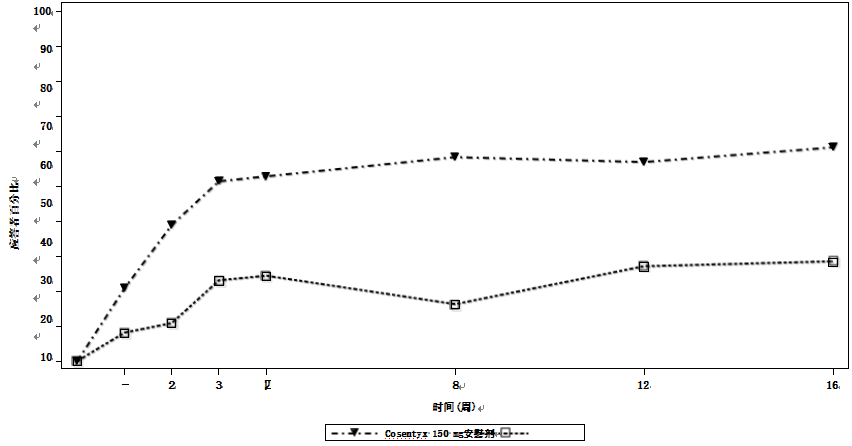
通过随访达到ASAS20应答的患者百分比见图。接受可善挺(苏金单抗、司库奇尤单抗)治疗但未接受负荷方案的安慰剂组患者随着时间的推移取得了类似的ASAS20应答(数据未显示)。
图:截至第16周(皮下治疗)一段时间内所有AS1研究患者的ASAS20反应
在AS3研究中,皮下注射可善挺(苏金单抗、司库奇尤单抗)(150毫克和300毫克)治疗的患者表现出改善的体征和症状,并且无论剂量如何,在主要和大多数次要终点方面,第16周的疗效反应均优于安慰剂。第16周时,ASAS20和ASAS40对150毫克的应答分别为58.1%和40.5%,对300毫克的应答分别为60.5%和42.1%。通过随访达到ASAS20应答的患者百分比见图。
在第16周时,根据ASQoL评估,与安慰剂治疗患者相比,可善挺(苏金单抗、司库奇尤单抗)治疗患者的健康相关生活质量有所改善。
图:直至第16周(皮下治疗)期间所有AS3研究患者的ASAS20反应
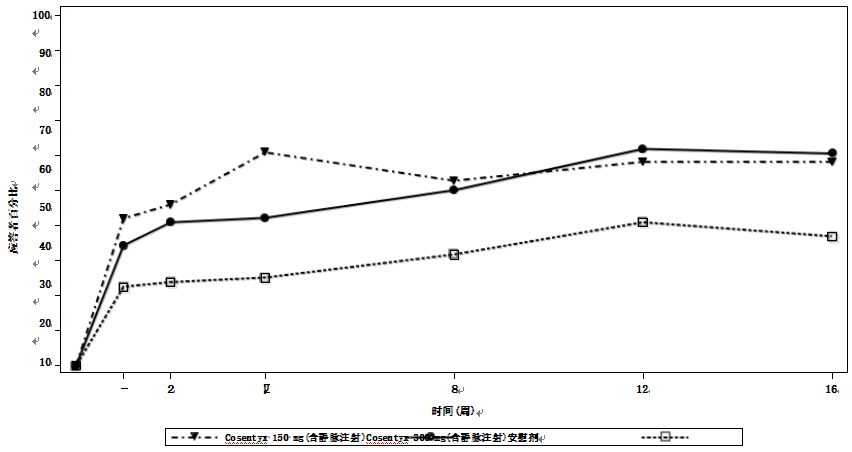
3)静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗成人活动性强直性脊柱炎
静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗成年活动性as患者的有效性是根据药代动力学暴露量确定的皮下注射可善挺(苏金单抗、司库奇尤单抗)治疗成年活动性AS患者的有效性推断出来的。
5、非影像学轴型脊椎关节炎
在一项随机、双盲、安慰剂对照的3期研究(nr-axSpA1,NCT02696031)中,对555名服用活性nr- axSpA的成年患者(18岁及以上)进行了可善挺(苏金单抗、司库奇尤单抗)的安全性和疗效评估。患者符合axSpA的ASAS标准,有炎症客观体征,并有活动性疾病,如BASDAI大于或等于4、视觉模拟评分(VAS)总背痛大于或等于40(评分范围为0-100毫米)所定义,尽管接受了NSAID治疗,且骶髂关节的放射学改变无证据符合AS的改良纽约州标准。患者还必须有炎症的客观体征,C反应蛋白(CRP)水平高于正常上限和/或磁共振成像(MRI)显示骶髂关节炎。
患者接受150毫克皮下可善挺(苏金单抗、司库奇尤单抗)治疗,有负荷剂量(第0、1、2、3和4周)或无负荷剂量(第0和4周),随后每4周接受相同剂量或安慰剂治疗。在双盲期,患者(n = 555)接受安慰剂或可善挺(苏金单抗、司库奇尤单抗)治疗52周。从第16周开始,允许调整剂量或添加合用NSAIDs和DMARDs。从第20周开始,根据研究者和患者的决定,允许患者改为每月皮下注射开放标签可善挺(苏金单抗、司库奇尤单抗)或其他生物制剂。主要终点是第52周时国际脊椎关节炎协会(ASAS40)的评估改善至少40%。
基线疾病特征
约10%和15%的患者分别合用MTX或柳氮磺吡啶。总体而言,10%的患者曾接受过抗TNFα药物的治疗,并因缺乏疗效或不耐受而中止治疗。
临床反应
在nr-axSpA1研究中,与安慰剂治疗相比,在第16周和第52周,可善挺(苏金单抗、司库奇尤单抗)150毫克治疗导致疾病活动性测量值显著改善。
表:NR-ax spa 1研究在第16周和第52周的临床反应(皮下治疗)
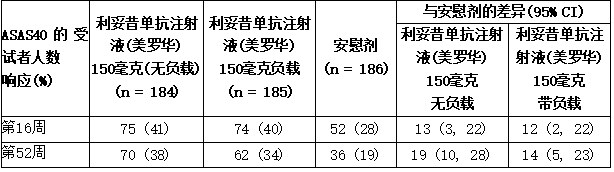
基于正态近似的95% CI比例差异。
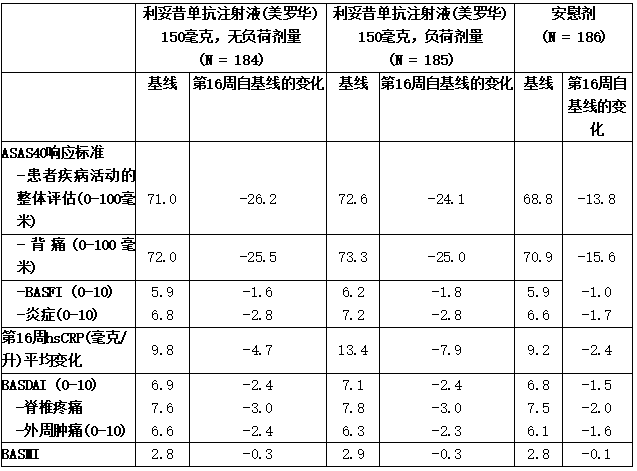
nr-axSpA1研究中的ASAS40响应标准主要成分的结果见表。
表:nr- axSpA 1研究(皮下治疗)中基线和第16周NR-ax spa患者的ASAS40应答标准的主要组成部分和疾病活动性的其他衡量标准
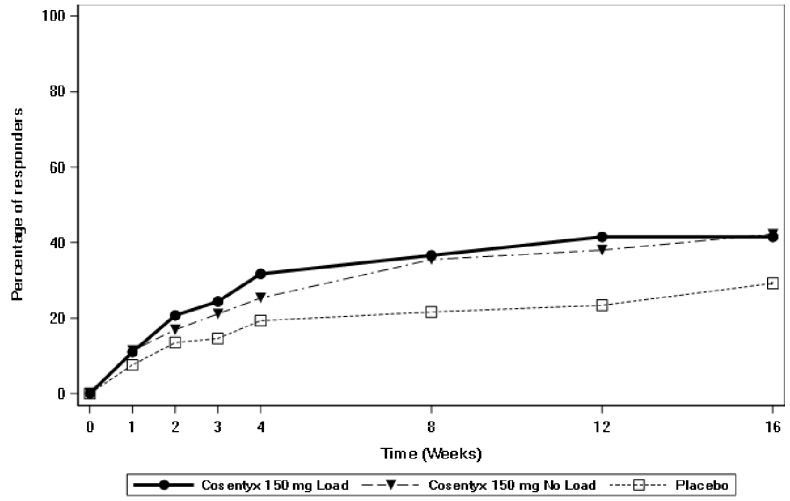
通过随访达到ASAS40应答的患者百分比见图。
图:至第16周(皮下治疗)期间nr-axSpA1研究中的ASAS40应答
1)与健康相关的生活质量
与安慰剂治疗患者相比,接受可善挺(苏金单抗、司库奇尤单抗)治疗的患者在第16周的健康相关生活质量(通过ASQoL测量,LS平均变化:第16周分别为:-3.5和-3.6与-1.8)方面均有所改善。
2)静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗活动性非影像学轴型脊柱关节炎成人患者
静脉注射可善挺(苏金单抗、司库奇尤单抗)治疗成年活性nr-axSpA患者的有效性是根据药代动力学暴露在成年活性nr-axSpA患者皮下注射可善挺(苏金单抗、司库奇尤单抗)的既定有效性推断出来的。
6、幼年型银屑病关节炎和附着点炎相关关节炎
在一项为期两年、分3部分、双盲、安慰剂对照、事件驱动、随机的3期研究(NCT03031782)中,对86例根据改良的国际风湿病学协会联盟(ILAR)幼年特发性关节炎(JIA)分类标准诊断为活动性ERA或JPsA的儿童患者(2至18岁)进行了皮下塞库单抗的疗效和安全性评估。该试验包括开放标签部分(第1部分),随后是随机停药(第2部分),随后是开放标签治疗(第3部分)。患者接受皮下注射如果体重小于50千克,则剂量为75毫克,如果体重至少大于50千克,则剂量为150毫克,在第0、1、2、3和4周通过皮下注射给药,之后每4周给药一次。
主要终点是第2部分中的爆发时间。疾病发作的定义是六项JIA ACR应答标准中的至少三项恶化至少30%,六项JIA ACR应答标准中的不超过一项改善至少30%,且至少有两个活动关节。
在开放标签的第1部分中,所有患者均接受皮下注射可善挺(苏金单抗、司库奇尤单抗)直至第12周。在第12周被归类为应答者(达到JIA ACR30应答)的患者进入第2部分双盲期,按1:1的比例被随机分配,继续接受可善挺(苏金单抗、司库奇尤单抗)治疗或开始接受安慰剂治疗。
1)基线疾病特征
进入研究时的JIA患者亚型为:60.5% ERA和39.5% JPsA。在本研究中,67.6%的JPsA病患者和63.5%的ERA患者接受了MTX联合治疗。
2)临床反应
在每个JIA亚型(JPsA和ERA)中观察到类似的应答。第12周时JPsA和ERA患者的JIA ACR 30、50、70和90应答参见下表。
表:第12周时JIA ACR 30、50、70和90的应答(皮下治疗)

3)幼年型银屑病关节炎结果
在第2部分期间,安慰剂组中总共有11名JPsA患者发生了耀斑事件,而可善挺(苏金单抗、司库奇尤单抗)组中有4名JPsA患者。与接受安慰剂的患者相比,接受可善挺(苏金单抗、司库奇尤单抗)的患者发生癫痫发作的风险降低了85%(危险比= 0.15,95% CI: 0.04至0.56)。
图:JPsA患者(皮下治疗)第2部分疾病发作时间的Kaplan-Meier估计
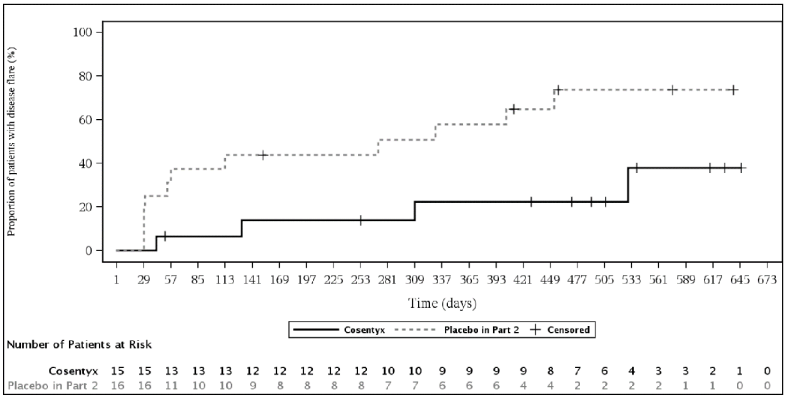
粘膜炎相关关节炎结果
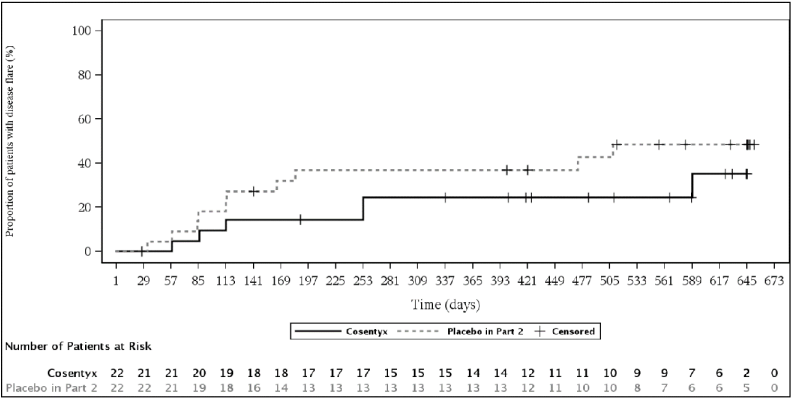
在第2部分期间,安慰剂组中总共有10名ERA患者发生耀斑事件,而secukinumab组中有6名ERA患者。与对照组相比,接受西库单抗治疗的患者发生皮疹的风险降低了53%接受安慰剂的患者(危险比= 0.47,95% CI: 0.17至1.32)。补充分析提供了ERA治疗效果的确证证据。
图:ERA患者(皮下治疗)在第2部分中疾病发作时间的Kaplan-Meier估计
7、化脓性汗腺炎
两项随机、双盲、安慰剂对照的52周3期试验(即HS试验1 [NCT03713619]和HS试验2 [NCT03713632])评估了可善挺(苏金单抗、司库奇尤单抗)治疗成人中重度化脓性汗腺炎(HS)的疗效和安全性。在两个试验中,受试者在第0、1、2、3和4周被随机分配接受安慰剂或可善挺(苏金单抗、司库奇尤单抗)300毫克皮下注射,随后每2周或每4周接受300毫克。在第16周,被随机分配到安慰剂组的受试者被重新分配到第16、17、18、19和20周服用可善挺(苏金单抗、司库奇尤单抗)300毫克,随后每2周服用可善挺(苏金单抗、司库奇尤单抗)300毫克(Q2W)或每4周服用可善挺(苏金单抗、司库奇尤单抗)300毫克(Q4W)。
1)基线人口统计和疾病特征
HS试验1和2包括1084名中度至重度HS的成年受试者。HS试验1评估了541名受试者,HS试验2评估了543名受试者,其中分别有13%和11%的受试者同时服用稳定剂量的全身性抗生素。在HS试验1和HS试验2中,分别有24%和23%的患者先前接受过生物制剂治疗(生物暴露患者),并因缺乏疗效或不耐受而停用生物制剂。
2)端点
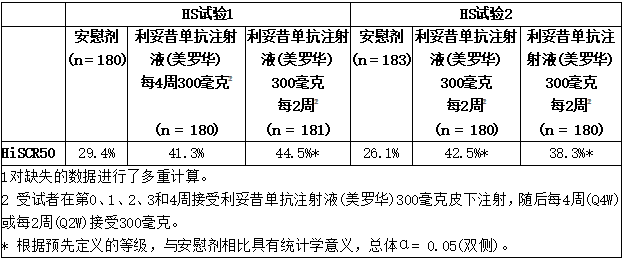
两项试验的主要终点是达到化脓性汗腺炎临床反应(HiSCR50)的受试者比例,his cr50定义为第16周时脓肿和炎性结节(AN)计数至少减少50%,脓肿数量和/或引流瘘数量相对于基线无增加。
3)临床反应
在HS试验1和HS试验2中,与安慰剂治疗的患者相比,每2周(前4周之后)接受可善挺(苏金单抗、司库奇尤单抗)300毫克治疗的受试者在第16周达到HiSCR50应答的比例在统计学上显著更高。在两项HS试验中,与安慰剂治疗的受试者相比,每4周(前4周之后)服用300毫克可善挺(苏金单抗、司库奇尤单抗)的受试者在第16周达到HiSCR50的比例较高,在HS试验2中达到了统计学意义。在这两项试验中,可善挺(苏金单抗、司库奇尤单抗)的作用最早发生在第2周,疗效逐渐增加直至第16周。
对于主要终点HiSCR50,接受任何抢救药物或病变干预的受试者被视为治疗失败,并作为无应答者处理(在HS试验1中,安慰剂组n=20,Q4W组11,Q2W组8;n=安慰剂组23人,Q4W组17人,HS试验2中Q2W组13人)。
在HS受试者中观察到主要终点有所改善,无论先前或同时进行的抗生素治疗或先前的生物暴露。
表:HS试验1和HS试验21中化脓性汗腺炎成人患者第16周的临床反应



互联网药品信息服务资格证书

孟加拉耀品国际授权书

孟加拉珠峰制药授权书

孟加拉伊思达制药授权书

孟加拉伊思达制药授权书

土耳其医院授权书
 正品保障
正品保障
 厂家直采
厂家直采
 专业药师
专业药师
 品类齐全
品类齐全