



宫颈癌和乳腺癌并称为女性两大“隐性杀手”。其中,乳腺癌的发病率更是位居女性恶性肿瘤的首位。随着现代医疗水平的发展,乳腺癌的治疗药物也在不断更新换代。2020年度圣安东尼奥乳腺癌研讨会(SABCS)对外公布的各项数据显示,乳腺癌新药——DS-8201对HER2阳性乳腺癌有着出色的疗效,它优秀的临床表现说明了其强劲的抗癌实力。
1.DS-8201简介及作用机制
DS-8201是一种针对HER2的抗体和拓扑异构酶抑制剂的偶联物,属于ADC类药物,这类药物疗效好、副作用小,适用于治疗无法切除或转移性HER2阳性乳腺癌。
DS-8201通过特殊连接物将抗体和化疗药连接在一起,抗体部分能够精准的找到癌细胞,把化疗药带到癌细胞面前,使其对癌细胞进行精准灭杀,同时,它还可以通过跨膜作用,灭杀旁邻的肿瘤细胞。
除了HER2阳性乳腺癌,DS-8201还适用于治疗HER2阳性的局部晚期或转移性胃及胃食管交界处腺癌的治疗。
2.DS-8201的发展历程
HER2靶向药物及ADC药物DS-8201问世之前,HER2阳性的乳腺癌患者通常采用化疗和手术疗法用来治疗,治疗过程漫长且痛苦。并且单纯使用化疗,约有一半的患者十年内出现了复发。
1998年赫赛汀正式被批准用于HER2乳腺癌的治疗,改变了乳腺癌的治疗模式,带来了不错的效果,但在实际治疗过程中部分患者出现耐药性和癌症复发的现象。
2013年出现了最早的ADC药物——T-DM1,这款药品集曲妥珠单抗和小分子细胞毒药物DM1于一身,在治疗过程中将细胞毒药物在HER2阳性表达的肿瘤细胞内释放,可以做到精准灭杀癌细胞。但它也有很多不足,比如穿越细胞膜的能力差,不能杀伤旁邻的癌细胞,没有旁杀伤效应等。
经过不断研究,DS-8201终于问世,2019年12月21日FDA正式批准DS-8201用于HER2阳性乳腺癌的后线治疗,给HER2阳性乳腺癌患者带来了新的希望。
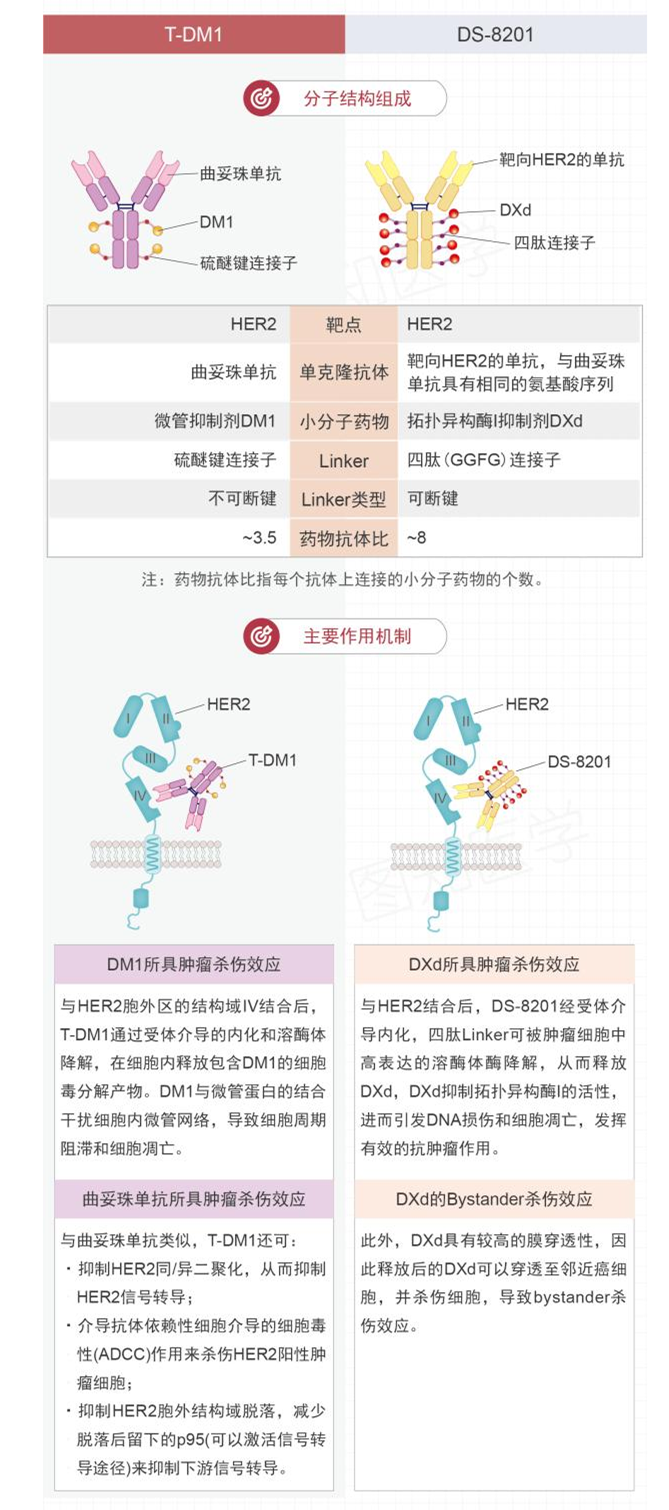
3.DS8201和T-DM1有何不同,优势在哪?
上文我们提到过,2013年出现了最早的ADC药物——T-DM1,但是他的临床治疗有局限性,因此DS-8201应运而生,那么这两者有何区别呢?
T-DM1和DS-8201同属于ADC类药物,但分子结构和作用机制大有不同。
简单来讲,DS-8201携带的DXd小分子药物的肿瘤杀伤作用优于T-DM1携带的DM1小分子药物,同时,DXd具有较高的膜穿透性,因此释放后的DXd可以穿透至邻近癌细胞,并杀伤细胞,有一定的杀伤效应。
同时,DS-8201避免了一定的耐药性,与T-DM1相比,它的抗肿瘤作用更强。
4. DS-8201的疗效及安全性
根据2018年美国临床肿瘤学会所公布的数据,在218名中位接受过4个前线治疗方案的受试者中,乳腺癌新药DS-8201所取得的成绩如下:86.3%的受试者在≥1次基线扫描出现肿瘤缩小的进展,总体缓解率ORR为49.3%。其中出现的药物反应均为恶性、食欲下降以及呕吐等低级别不良事件。根据大会的研究结论,乳腺癌新药DS-8201效果显著,安全性可管理。
5.DS-8201的服用剂量
对于使用DS-8201治疗乳腺癌的时间没有固定数值,要根据患者个人的病情和体质来制定治疗疗程,具体效果也因人而异。
注意:DS-8201不可用于替代,请勿将曲妥珠单抗或曲妥珠单抗-美坦新偶联物(TDM-1)替代DS8201使用或和DS-8201混用。
具体的服用剂量如下:
DS-8201的推荐剂量为5.4 mg/kg,每3周一次(21天周期)静脉滴注,直至疾病进展或出现不可接受的毒性。
首次注射:90分钟以上。如果先前的输注耐受性良好,则第二次滴注不少于30分钟。
滴注时如果患者出现与输注相关的症状,须减慢或中断输注速度;如果发生严重的输注反应,须永久停用。
如果治疗过程中产生不良反应,可采取减剂量做法:首次减剂至4.4mg/kg,第二次减剂至3.2mg/kg,最后可采取停用做法。
如果用药延迟或漏用,应尽快给药;不用等到下一个计划的周期。保持每3周一次,以患者最近一次输液中耐受的剂量和速率进行输液。
6.不良反应
DS-8201常见的副作用包括有Hgb降低、白细胞减少、中性粒细胞计数下降、疲劳、脱发、ALT/AST增加、血小板数量减少、食欲下降、贫血、头痛等等。
其中,最常见的几个不良反应有以下几种:
1、间质性肺炎:这最严重,间质性肺炎如果控制不住,有可能引起致命的后果。这种比较严重的毒副反应,临床试验数据中大概的发生率在9%左右,首次发作的中位时间,一般在四个月左右。
2、骨髓抑制:最主要的表现就是中性粒细胞减少,因为ADC药物中抗体携带的是化疗药,所以也会引起骨髓抑制。
3、心脏功能下降:需要引起注意,尤其是影响左心功能下降以后,发生充血性心力衰竭,由于表皮生长因子受体2被拮抗以后引起的毒副反应,发生率相对比较少。
由于每个患者的病情以及身体情况不同,服用后出现的副作用程度以及表现都不同。出现严重的不良反应时请及时通知医生,不要盲目用药。
7.DS8201的获批历史回顾
2019年12月DS-8201在美国上市,FDA加速批准阿斯利康的DS-8201,用于治疗无法切除或转移性HER2阳性乳腺癌,商品名为Enhertu。
2020年3月,日本厚生劳动省(MHLW)批准DS8201,用于治疗HER2阳性、不可且出行或转移性以及经过化疗后但仍复发的乳腺癌患者。
2021年01月20日, 阿斯利康(AstraZeneca)与第一三共制药(Daiichi Sankyo)联合宣布,欧盟委员会(EC)有条件批准Enhertu(DS-8201)作为单药疗法,用于治疗先前已接受了2种或2种以上的抗HER2治疗方案的不可切除性或转移性HER2阳性乳腺癌成人患者。
8.DS-8201上市情况及获取渠道
DS-8201已经相继在美国、日本、欧洲上市,目前还没有在国内上市,且上市时间未定。
所以,国内的患者如有需要只能通过海外医疗机构(如:医伴旅)获取国外上市的版本。
9.日本版DS-8201颇受患者关注
DS-8201在国外上市后比较稀有,并且价格昂贵,目前有美版、日版、欧洲版。其中,日版的价格相比于其他两个版本较低,是受患者关注较多的版本。
10.DS-8201后期展望
随着研究的不断深入,科学家们发现DS-8201除了对HER2高表达的乳腺癌有着显著的治疗效果,还对HER2低表达的乳腺癌、胃癌以及食道癌也有着不错的疗效。行业内的研究人员以及医患人员都对DS-8201给予了极大的期望,在不远的将来,相信DS-8201将为更多患者带来福音。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
