



2020年5月,默沙东公司(在美国和加拿大被称为默克公司)和日本卫材公司(Eisai)宣布了KEYNOTE-524/116号试验的最新数据,数据显示抗PD-1药物帕博利珠单抗(pembrolizumab,Keytruda, 派姆单抗,可瑞达)联合口服多受体酪氨酸激酶抑制剂乐伐替尼(lenvatinib,Lenvima)在未接受系统治疗的不可切除性肝细胞癌(HCC)患者中显示出具有临床意义的客观缓解率(ORR)。
KEYNOTE-524/116号试验
KEYNOTE-524/116号试验(NCT03006926)是一项1b期、非盲、单臂试验,评估了帕博利珠单抗和乐伐替尼联合治疗100例未经系统治疗的不可切除性肝细胞癌患者。患者每三周静脉注射帕博利珠单抗200mg,联合每日口服一次乐伐替尼8或12mg(按照基线体重˂60公斤或≥60公斤)。
主要终点是ORR和缓解持续时间(DOR)。次要终点包括无进展生存期(PFS)、疾病进展时间(TTP)和总生存期(OS)。数据截止时(2019年10月31日),中位随访持续时间为10.6个月(95%CI:9.2-11.5),仍有37名患者在接受试验治疗,该联合疗法的中位治疗持续时间为7.9个月(范围:0.2-31.1)。
试验结果
试验主要终点的最终分析显示,独立成像检查(IIR)按照RECIST v1.1标准评估,帕博利珠单抗和乐伐替尼组合的ORR为36%(n=36)(95%CI:26.6-46.2),完全缓解率为1%(n=1),部分缓解率为35%(n=35),中位DOR为12.6个月(95%CI:6.9-不可估计[NE])。IIR按照mRECIST标准评估,该组合的ORR为46%(n=46)(95%CI:36.0-56.3),完全缓解率为11%(n=11),部分缓解率为35%(n=35),中位DOR为8.6个月(95%CI:6.9-NE)。
安全性
治疗相关不良事件(TRAE)导致6%的患者停止帕博利珠单抗和乐伐替尼,10%的患者停止帕博利珠单抗,14%的患者停止乐伐替尼。67%的患者发生≥3级的TRAE(3级:63%;4级:1%;5级:3%)。任何级别最常见的TRAE(≥20%)为高血压(36%)、腹泻(35%)、疲劳(30%)、食欲下降(28%)、甲状腺功能减退(25%)、手足综合征(23%)、体重减轻(22%)、发音困难(21%)、天冬氨酸转氨酶升高(20%)和蛋白尿(20%)。
突破性疗法认定
2019年7月,美国食品和药物管理局(FDA)授予了帕博利珠单抗联合乐伐替尼一线治疗晚期不可切除性肝细胞癌(HCC)患者(不能接受局部治疗)的突破性疗法认定。该认定的授予是基于KEYNOTE-524/116号试验中期分析的发现。
临床招募
目前,一项国际临床试验——帕博利珠单抗和仑伐替尼联合TACE治疗不可治愈/非转移性肝细胞癌的III期研究,正在进行临床招募,具体信息如下:
试验目的:
在不可治愈/非转移性肝细胞癌受试者中评价仑伐替尼(E7080/MK-7902)与帕博利珠单抗(MK-3475)联合经动脉化疗栓塞(TACE)与TACE比较安全性和有效性
试验设计:
试验分类:安全性和有效性 试验分期:3期 设计类型:平行分组 随机化:随机化 盲法:双盲 试验范围:国际多中心试验
入选标准:
1.通过影像学、组织学或细胞学确诊HCC(纤维板层和混合肝细胞/胆管癌亚型不符合条件) 2.HCC局限于肝脏,无门静脉血栓形成,不适合根治性治疗,如切除、消融或肝移植。经BICR确认无肝外HCC。 3.由BICR根据RECIST 1.1确认至少具有一处可测量HCC病灶。 4.所有病灶均可接受1或2期(分次TACE)TACE治疗。 5.适合研究中心预先规定的TACE手术和化疗药物,无任何禁忌症。 6.在第一剂研究干预给药前7天内的CP A级肝脏评分 7.已控的HBV受试者
排除标准:
1.经BICR确认,任何维度上≥10 cm的HCC病灶,影像学评价病灶超过10个或HCC病灶占肝脏体积≥50%。 2.是目前肝移植的候选者。 3.在近6个月内发生过食管或胃静脉曲张破裂出血。 4.存在出血或血栓性疾病或使用需要监测INR的 X因子抑制剂 或抗凝剂,如华法林或类似药物。 5.体格检查中有临床明显的腹水,不能用药物控制。 6.经BICR证实门静脉存在任何大血管肿瘤血栓形成。 (注:以上为部分标准,最终入选由研究人员确定)
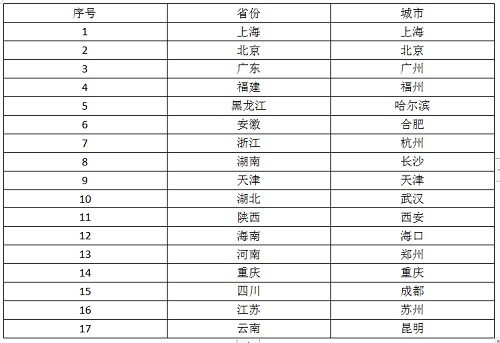
主要研究中心所在地(具体启动情况以后期咨询为准)
如果想了解更多信息,可联系医伴旅团队,我们将为您解惑。联系电话:400-001-2811
参考文献: https://www.businesswire.com/news/home/20200528005868/en/KEYTRUDA%C2%AE-pembrolizumab-LENVIMA%C2%AE-lenvatinib-Combination-Demonstrated-Clinically https://www.onclive.com/view/fda-grants-breakthrough-designation-to-frontline-pembrolizumablenvatinib-for-hcc
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
