



美国食品和药物管理局(FDA)授予了癌症免疫疗法新药tiragolumab突破性疗法认定(BTD),其联合阿替利珠单抗(atezolizumab,Tecentriq)用于一线治疗转移性非小细胞肺癌(NSCLC)患者,这些患者的肿瘤具有高PD-L1表达,无EGFR或ALK基因组肿瘤畸变,该药物的开发商罗氏公司宣布。

Tiragolumab是第一个被授予BTD的抗TIGIT分子,该认定的授予是基于全球、双盲、随机、2期CITYSCAPE试验(NCT03563716)的数据。该试验评估了tiragolumab联合阿替利珠单抗对比阿替利珠单抗联合安慰剂一线治疗PD-L1阳性、局部晚期不可切除或转移性NSCLC患者的疗效。
试验设计
参与本试验的患者按1:1随机分组,一组静脉注射(IV)600mg tiragolumab加1200mg 阿替利珠单抗,另一组静脉注射安慰剂加阿替利珠单抗,每3周一次,直至疾病进展或失去临床疗效。试验的两个主要终点是总缓解率(ORR)和无进展生存期(PFS)。关键次要终点包括安全性和总生存期。
按照2020年美国临床肿瘤学会(ASCO)虚拟科学项目上发布的试验结果,到目前为止,tiragolumab联合疗法已经展示出良好的疗效和安全性。
罗氏公司首席医疗官兼全球产品开发主管Levi Garraway博士说:“近10年来,我们一直将TIGIT作为一个新型癌症免疫治疗靶点进行研究,很高兴FDA能够看到tiragolumab的潜力,认可其能够显著改善某些类型肺癌患者的预后。我们期待着推进tiragolumab的开发计划,包括无化疗联合治疗和多种癌症类型(医疗需求未得到满足)的早期试验。”
试验结果
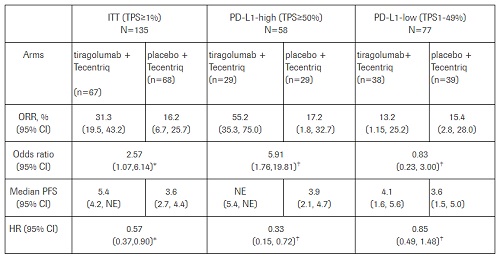
2019年6月30日(初步分析日期),tiragolumab组的ORR为31.3%(95%CI,19.5%-43.2%),安慰剂组为16.2%(95%CI,6.7%-25.7%),优势比为2.57(95%CI,1.07-6.14)。此外,tiragolumab组的中位PFS为5.4个月(95%CI,4.2-不可评估),而安慰剂组为3.6个月(95%CI,2.7-4.4),危险比为0.57(95%CI,0.37-0.90)。
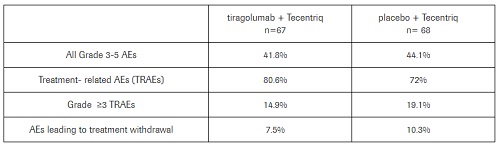
关于安全性,tiragolumab组和安慰剂组的治疗相关不良事件(TRAE)发生率分别为80.6%和72.0%;3级或以上TRAE的发生率分别为14.9%和19.1%。此外,导致治疗中断的不良事件发生率分别为7.5%和10.3%。
2019年12月2日(新截止日期),研究人员发现,额外随访6个月(中位随访10.9个月),tiragolumab组对比安慰剂组,保持了ORR和中位PFS的改善。tiragolumab组的ORR为37.3%(95%CI,25.0%-49.6%),中位PFS为5.6个月(95%CI,4.2-10.4);而安慰剂组的ORR为20.6%(95%CI,10.2%-30.9%),中位PFS为3.9个月(95%CI,2.7-4.5)。安全性保持了可耐受。
值得注意的是,对PD-L1高水平患者(肿瘤比例得分≥50%)进行的探索性分析显示,tiragolumab组与安慰剂组相比,ORR具有临床意义(66%对24%);tiragolumab组的中位PFS未达到,而安慰剂组为4.11个月(HR,0.30;95%CI,0.15-0.61)。
生物标志物分析
罗氏公司表示,CITYSCAPE试验的生物标志物分析将在2021年1月举行的国际肺癌研究协会(IASLC)肺癌世界会议上发表。
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。



