



欧盟委员会已批准阿维单抗(Bavencio,avelumab)作为前线维持治疗方案,用于治疗接受铂类化疗后没有进展的局部晚期或转移性尿路上皮癌成人患者。
该决定是根据3期JAVELIN Bladder 100试验预先指定的中期分析的数据之后做出的,该数据显示,与单独使用最佳支持治疗(BSC)相比,阿维单抗加BSC的一线维持治疗使生存期显著改善,中位总生存期分别为21. 4个月与14.3个月,同时,PD-L1阳性患者的生存期也得到了显著改善。
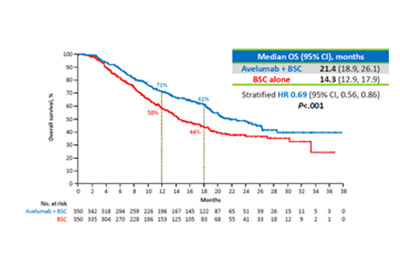
在2020年1月19日的数据截止时,更新的研究结果证明:与BSC单药相比,阿维单抗延长了所有随机参与者的OS。研究组的中位OS为22.1个月,而对照组为14.6个月。
试验的其他结果显示,在总体患者人群中,研究组的中位PFS为3.7个月,而对照组的中位PFS为3.7个月,研究组降低了38%的复发和转移风险。在PD-L1阳性肿瘤患者亚组中,研究发现复发和转移风险的降低也有利于接受免疫治疗。
Avelumab的耐受性非常好。在344名接受免疫治疗的患者和345名单独接受BSC的患者中,任何等级、任何原因的毒性报告分别为95%与77%。大约47%接受阿维单抗联合BSC的患者出现3到4级不良反应,而单独接受BSC的患者则有25.2%。
最常报告的3级或更高的毒性包括尿路感染、贫血、血尿、疲劳和背痛。
2020年6月,FDA批准阿维单抗作为维持用药,用于经前线铂类化疗未进展的局部晚期或转移性尿路上皮癌患者。2017年,该免疫疗法获得FDA加速批准,用于治疗在含铂化疗期间或之后出现疾病进展的局部晚期或转移性尿路上皮癌患者,或在含铂化疗新辅助或辅助治疗后12个月内出现进展的患者。
参考资料:Avelumab Approved in Europe for Frontline Maintenance in Metastatic Urothelial Carcinoma
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
