



新加坡2020年世界肺癌会议上公布的1/2期试验(NCT02247349)的最新数据显示,抗岩藻糖基-GM1单克隆抗体BMS-986012加入纳武单抗(nivolumab,Opdivo)治疗复发/难治性小细胞肺癌(SCLC)患者(从未接受免疫检查点抑制剂作为系统治疗的一部分)时,能够诱导良好的结果。
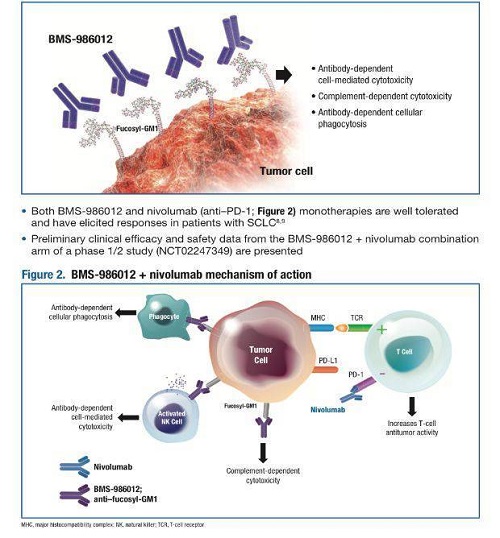
此外,相比单独使用纳武单抗,该联合疗法诱导了更好的缓解。
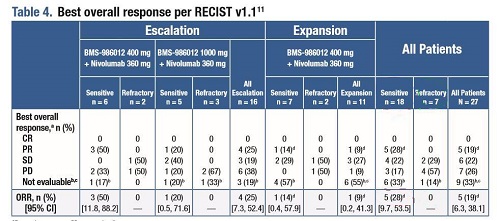
杜克癌症研究所的医疗肿瘤学家Neal Ready博士展示数据时说:“29名患者中有11名(38%)有完全的RECIST缓解。类似情况下,纳武单抗单药治疗的历史缓解率为12%,与之相比,该联合疗法的缓解率是有利的。”
试验设计
这项首次人体、剂量递增和扩大试验共招募了29名复发/难治性SCLC患者(中位年龄65岁,范围46-79岁),超过一半(52%)是男性,均为白人,其中大多数(76%)现在或以前吸烟。要加入该试验,每位患者必须至少接受过一次以铂为基础的治疗;但是,之前接受过免疫治疗的患者不能加入该试验。
在试验的第一部分,患者每3周静脉注射一次360mg纳武单抗,联合每3周接受一次400mg的BMS-986012(n=8)或1000mg的BMS-986012(n=8)。剂量递增试验确定了该联合疗法的理想剂量为400 mg BMS-986012,并另外招募了13名患者。该试验的主要终点是联合用药的安全性。其他关键终点包括缓解率、缓解持续时间(DOR)和无进展生存期(PFS)。
安全性
Ready博士说:“我们看到了纳武单抗典型的免疫相关毒性,以及一些与BMS-986012相关的额外毒性,主要是皮肤病,瘙痒是最突出的副作用。瘙痒通常开始于药物输注时,一般为1级或2级,并且通常随着时间的推移而改善。”
与治疗相关的其他任何级别不良事件(AE)包括皮肤干燥(28%)、疲劳(28%)和甲状腺功能减退(17%)。400mg组和1000mg组分别有2名和3名患者因毒性而停止接受联合用药。
3/4级治疗相关不良事件包括腹泻、胰腺炎、脂肪酶升高、脱水和肝衰竭各1例。
Ready博士说,值得注意的是,1名在杜克癌症研究所接受治疗的患者在38个月的时间里接受了56个周期的联合治疗。
其他终点
Ready博士还指出,数据截止时,中位DOR为26.4个月(95%CI,4.4个月-未达到[NR]),引人瞩目。事实上,数据截止时,仍有4名患者还在接受试验疗法。
试验中所有患者的中位总生存期为18.7个月(95%CI,8.2-NR),中位PFS为2.1个月(95%CI,1.4-9.9)。
总结
Ready博士说:“这些结果充满希望,尽管样本量很小。即将开始的随机2期试验将会研究该抗岩藻糖基-GM1单克隆抗体的总体目标,在该试验中,患者将接受卡铂、依托泊苷和纳武单抗的联合治疗,加或不加该抗岩藻糖基-GM1单克隆抗体。计划在2021年初开始招募患者。”
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。



