欧洲药品管理局人用药品委员会建议扩大帕博丽珠单抗(pembrolizumab,Keytruda)的适应症范围,作为单药用于3岁及以上的复发/难治性类霍奇金淋巴瘤成人和儿童患者,这些患者的自体干细胞移植(ASCT)失败,或经过至少两次治疗后无法进行ASCT治疗。
积极的意见是基于3期KEYNOTE-204试验(NCT02684292)的数据,根据2020年ASCO虚拟科学计划期间公布的数据,在复发/难治性类霍奇金淋巴瘤患者中,使用PD-1抑制剂帕博丽珠单抗治疗比本妥昔单抗(Brentuximab vedotin/ Adcetris)有4.9个月的无进展生存期(PFS)获益。
使用帕博丽珠单抗的中位PFS为13.2个月,而使用本妥昔单抗的中位PFS为8.3个月。非ASCT候选者的患者,原发性难治性疾病患者和从未接受过本妥昔单抗治疗的患者使用帕博丽珠单抗比使用本妥昔单抗也有PFS获益。
该建议也是基于3期KEYNOTE-087试验(NCT02453594)更新的数据,该试验支持欧洲批准帕博丽珠单抗用于治疗复发/难治性类霍奇金淋巴瘤患者,这些患者在ASCT和本妥昔单抗疗法中均失败,且不适合移植,且服用本妥昔单抗后复发。
在试验中,患者分别随机接受静脉注射(IV)帕博丽珠单抗,或者静脉注射本妥昔单抗。 数据显示,帕博丽珠单抗组的无进展生存期(PFS)为12.6个月,而本妥昔单抗组为8.2个月;12个月的PFS率分别为50.4%和33.3%。根据研究者评估,帕博丽珠单抗组的中位PFS为19.2个月,而本妥昔单抗组为8.2个月。
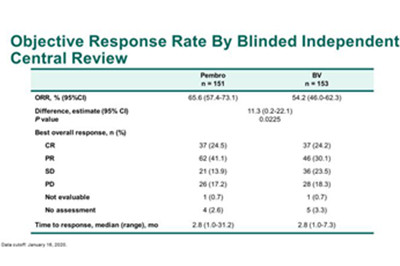
此外,帕博丽珠单抗组的客观缓解率(ORR)为65.6%,而本妥昔单抗组为54.2%。在帕博丽珠单抗组中,客观缓解率由24.5%的完全缓解率、41.1%的部分缓解率和13.9%的疾病稳定率组成。26名患者(17.2%)在研究组出现了进展性疾病。
帕博丽珠单抗组最常见的与治疗相关的不良安全事件(AE)包括甲状腺功能减退(15.5%)、发热(12.8%)、瘙痒(10.8%)、疲劳(8.8%)、恶心(4.1%)、周围神经病变(2.0%)和周围感觉神经病变(2.0%)。
2017年3月,FDA加速批准pembrolizumab用于成人和儿童经典霍奇金淋巴瘤患者,这些患者在接受3种或3种以上治疗后难治或复发。
2020年10月,FDA批准pembrolizumab作为单一药物用于复发或难治性经典霍奇金淋巴瘤的成人患者;FDA还批准了最新的儿科适应症,用于治疗难治性经典霍奇金淋巴瘤或经典霍奇金淋巴瘤的儿童患者,这些患者在接受2种或2种以上治疗后复发。
此次帕博丽珠单抗如果获得批准,这将是其在欧盟的首个儿童适应症。
参考资料:Pembrolizumab Approaches EU Approval for Expanded Indication in Relapsed/Refractory Hodgkin Lymphoma
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。