



1、转移性默克尔细胞癌
阿维鲁单抗(阿维单抗)的有效性和安全性在 JAVELIN Merkel 200试验(NCT02155647)中得到了证实,这是一项开放标签、单臂、多中心研究,在组织学证实的转移性MCC患者中进行。该试验由两部分组成;A部分纳入了在接受远处转移性疾病化疗时或化疗后病情进展的转移性MCC患者,B部分纳入了未接受治疗的转移性MCC患者。该试验排除了自身免疫性疾病患者;需要全身免疫抑制的疾病;既往器官或异体干细胞移植;既往使用抗pd-1、抗pd-L1或抗CTLA-4抗体治疗;中枢神经系统转移;感染艾滋病毒、乙型肝炎或丙型肝炎;或ECOG表现评分≥2。
患者每2周静脉注射10毫克/千克,静脉滴注60分钟以上,直到疾病进展或产生不可接受的毒性。放射学疾病进展与显著的临床恶化无关的患者,定义为没有新的或恶化的症状,表现状态超过2周没有变化,不需要挽救性治疗,可以继续治疗。每6周进行一次肿瘤反应评估。
主要疗效结果指标根据由盲法独立中央评估委员会(IRC)评估的实体肿瘤疗效评估标准(RECIST)v1.1和IRC评估的疗效持续时间确定总体缓解率(ORR)。
1)既往治疗过的默克尔细胞癌
A部分共纳入88例患者。基线患者特征的中位年龄为73岁(范围:33-88岁),74%的患者为男性,92%为白人,ECOG表现评分为0(56%)或1(44%)。75%的患者为65岁或以上,35%为75岁或以上,3%为85岁或以上。据报道,65%的患者之前曾接受过一次转移性MCC的抗癌治疗,35%的患者之前曾接受过两次或两次以上的治疗。53%的患者有内脏转移。66%的pdl1阳性(≥1%的肿瘤细胞),18%的PD-L1阴性,16%的免疫组化结果无法评估。对档案肿瘤样本进行了默克尔细胞多瘤病毒(MCV)的调查性评估;在77例有可评估结果的患者中,52%有MCV的证据。
疗效结果汇总见下表。无论肿瘤PD-L1是否表达或MCV是否存在,患者均可观察到反应。
表:JAVELIN Merkel 200试验在既往治疗的转移性MCC患者中的疗效结果(A部分)
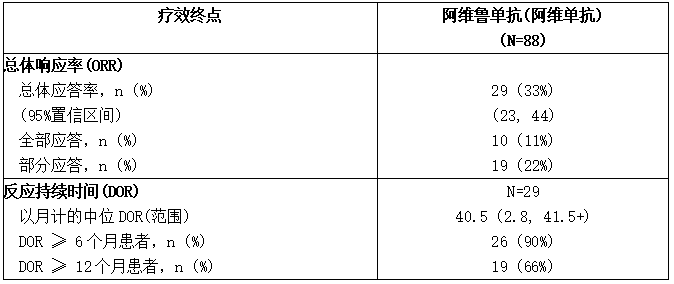
CI:置信区间。
2)接受初始治疗的默克尔细胞癌
B部分共纳入116例患者。基线患者特征中位年龄为74岁(范围:41至93);70%的患者为男性;65%为白人,31%为未知或未收集,2.6%为亚洲人,1.7%为黑人;ECOG表现评分为0(62%)或1(38%)。18%的患者pd-l1阳性(≥1%),75%的患者pd-l1阴性,7%的患者通过免疫组化检测无法评估结果。60%的患者患有默克尔细胞多瘤病毒(MCV)。
疗效结果见下表。无论肿瘤PD-L1是否表达或MCV是否存在,患者均可观察到反应。
表:JAVELIN Merkel 200试验对治疗单纯转移性MCC患者的疗效结果(B部分)
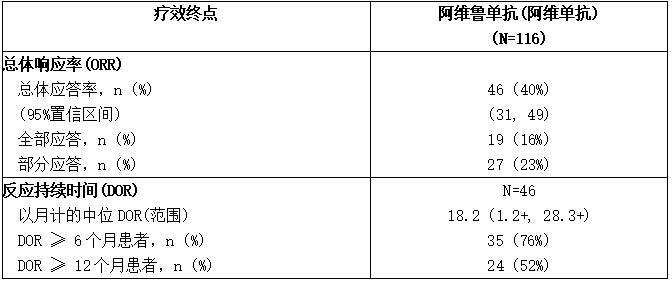
CI:置信区间。
2、局部晚期或转移性尿路上皮癌
1)尿路上皮癌的一线维持治疗
JAVELIN Bladder 100(NCT02603432)证实了其有效性和安全性,这是一项随机、多中心、开放标签的研究,对700例不可切除、局部晚期或转移性尿路上皮癌患者进行,这些患者在一线含铂化疗后没有进展。自身免疫性疾病或需要免疫抑制的患者被排除。
在开始一线化疗时,根据对化疗的最佳反应(CR/PR与稳定疾病[SD])和转移部位(内脏与非内脏)进行随机分层。患者随机(1:1)接受每2周静脉注射10毫克/千克加最佳支持治疗(BSC)或单独注射BSC。在最后一次化疗后的4-10周内开始治疗。
通过盲法独立中心审查(BICR)评估或不可接受的毒性。如果患者临床稳定,研究者认为具有临床益处,则允许在RECIST定义的疾病进展之外给予治疗。在基线、随机分组后8周进行肿瘤状态评估,然后在随机分组后每8周至12个月进行一次,之后每12周进行一次,直至根据RECIST v1.1的BICR评估记录了确认的疾病进展。
基线特征在各组之间平衡良好。总体上,中位年龄为69岁(范围:32至90岁),66%的患者年龄≥65岁,24%的患者年龄≥75岁。大多数患者为男性(77%)。大多数患者为白人(67%),22%为亚裔。基线ECOG PS为0 (61%)或1 (39%)。
56%的患者既往接受过吉西他滨联合顺铂治疗,38%的患者既往接受过吉西他滨联合卡铂治疗,6%的患者既往接受过吉西他滨联合顺铂治疗和吉西他滨联合卡铂治疗。一线化疗的最佳反应为CR或PR (72%)或SD (28%)。化疗前的转移部位为内脏(55%)或非内脏(45%)。51%的患者患有PD-L1阳性肿瘤,39%的患者患有PD-L1阴性肿瘤,10%的患者具有未知的PD-L1肿瘤状态。在阿维鲁单抗(阿维单抗)+BSC组和BSC组中,分别有6%和44%的患者在停止治疗后服用了另一种PD-1/PD-L1检查点抑制剂。
主要疗效结局指标是所有随机分配患者和PD-L1阳性肿瘤患者的总生存率(OS)。一项预先确定的中期分析的结果显示,与单独使用BSC相比,随机分配到阿维鲁单抗(阿维单抗)+BSC组的患者OS有统计学意义的改善。当观察到452例死亡时,进行了更新的OS分析。在预先指定的CR/PR与SD亚组中观察到了一致的一线化疗结果。
表:JAVELIN Bladder 100试验的疗效结果
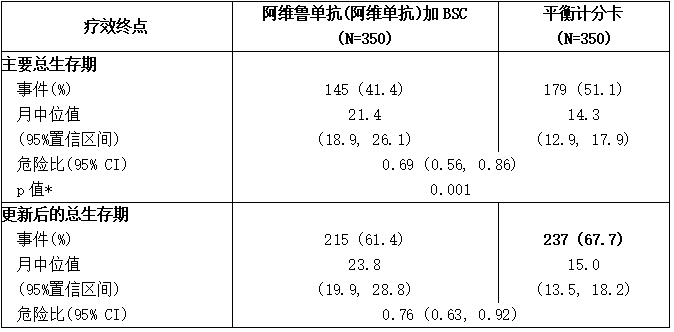
BSC:最佳支持性治疗;CI:置信区间;OS:总生存率。
*基于双侧分层对数秩的p值。
图:JAVELIN Bladder 100试验更新后的总生存期的K-M估计
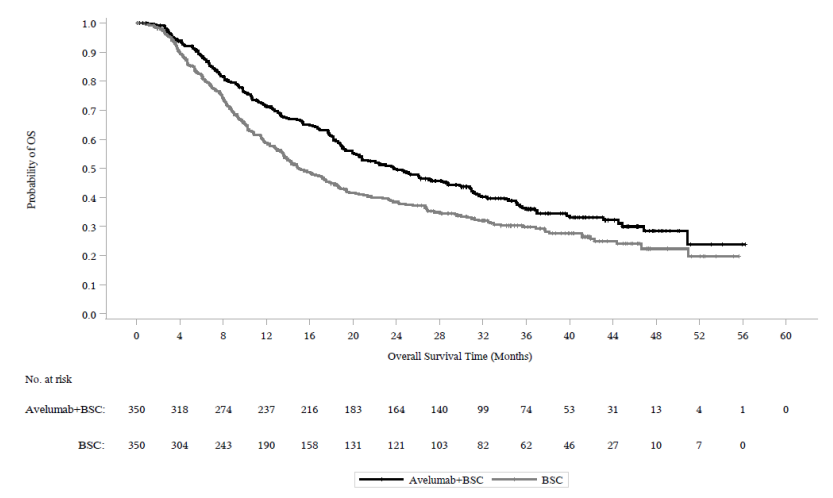
在pd-=1阳性肿瘤患者的预先指定的OS终点(n=358,51%),在随机接受巴文cio+BSC与单独BSC患者的更新OS分析中,风险比为0.69(95% CI: 0.52,0.90)。在一项对pd-l1阴性肿瘤患者(n=270,39%)的探索性分析中,更新的OS风险比为0.82(95% CI: 0.62,1.09)。
2)既往治疗过的尿路上皮癌
阿维鲁单抗(阿维单抗)的有效性和安全性在JAVELIN Solid Tumor试验的UC队列中得到了证实,JAVELIN Solid Tumor试验是一项开放标签、单臂、多中心研究,纳入了242例局部晚期或转移性尿路上皮癌(UC)患者,这些患者在含铂化疗期间或之后出现疾病进展,或在接受含铂新辅助或辅助化疗方案治疗后12个月内出现疾病进展。中枢神经系统有活跃或有转移病史的患者;5年内其他恶性肿瘤;器官移植;需要治疗性免疫抑制的疾病;或活动性感染HIV,乙型肝炎或丙型肝炎被排除在外。除I型糖尿病、白癜风、牛皮癣或甲状腺疾病外,不需要免疫抑制治疗的自身免疫性疾病患者被排除在外。无论患者的PD-L1状态如何,均纳入研究。
226例随访至少13周的患者的基线人口统计学和疾病特征为中位年龄68岁(范围:30-89),72%为男性,80%为白人,34%和66%的患者的ECOG表现状态分别为0和1。44%的患者患有非膀胱尿路上皮癌,包括23%的上呼吸道疾病患者,83%的患者有内脏转移(基线靶和/或非靶病变)。9例(4%)患者在既往仅接受过含铂的新辅助治疗或辅助治疗后出现疾病进展。47%的患者之前只接受了基于顺铂的方案,32%之前只接受了基于卡铂的方案,20%同时接受了基于顺铂和卡铂的方案。在基线时,17%的患者的血红蛋白为小于10克/分升,34%的患者有肝转移。
疗效结果见表。随访大于13周或大于6个月的患者的中位反应时间为2.0个月(范围:1.3-11.0)。使用临床试验试验来评估PD-L1染色,16%的患者无法评估,基于PD-L1肿瘤表达的应答率没有明显差异。在随访大于13周的总30例应答患者中,22例(73%)持续应答6个月或更长时间,4例(13%)持续应答12个月或更长时间。在随访大于6个月的26例应答患者中,22例(85%)有持续6个月或更长时间的应答,4例(15%)有持续12个月或更长时间的应答。
表: JAVELIN Solid Tumor试验中UC队列的疗效结果
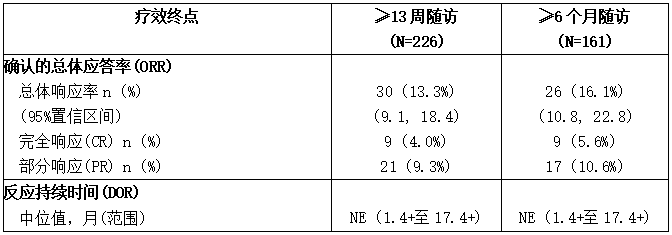
CI:置信区间;NE:不可估计;+表示删失值。
3、晚期肾细胞癌
在JAVELIN Renal 101试验(NCT02684006)中证明了阿维鲁单抗(阿维单抗)联合阿昔替尼的疗效和安全性,该试验是一项随机、多中心、开放标签研究,对886例未经治疗的晚期RCC患者进行了阿维鲁单抗(阿维单抗)联合阿昔替尼治疗,无论肿瘤PD-L1表达如何[意向治疗(ITT)人群]。自身免疫性疾病或需要全身免疫抑制的疾病患者被排除在外。
随机分配按东部肿瘤协作组(ECOG)绩效状态(PS) (0对1)和地区(美国对加拿大/西欧对世界其他地区)分层。患者被随机(1:1)分配到以下治疗组之一:
a.阿维鲁单抗(阿维单抗)10毫克/千克静脉输注,每2周一次,与阿西替尼5毫克联合口服,每日两次(N=442)。每日两次耐受5毫克阿西替尼且连续2周无2级或更高阿西替尼相关不良事件的患者可增至7毫克,随后增至每日两次10毫克。可中断使用阿昔替尼或将剂量降至3毫克每日两次,随后降至2毫克每日两次,以控制毒性。
b.舒尼替尼50毫克,每日一次,口服,持续4周,然后停药2周(N=444),直至出现影像学或临床进展或出现不可接受的毒性。
继续使用阿维鲁单抗(阿维单抗)和阿西替尼的治疗,直到RECIST v1.1-defined通过盲法独立中心审查(BICR)评估或不可接受的毒性的疾病进展。如果患者临床表现稳定,且研究者认为可获得临床益处,则允许给药患者和阿西替尼超越RECIST定义的疾病进展。在基线时评估肿瘤状态,在随机分组后6周,然后每6周进行一次,直到随机分组后18个月,之后每12周进行一次,直到BICR证实疾病进展。
基线特征为中位年龄为61岁(范围:27-88岁),38%的患者为65岁或以上,75%为男性,75%为白人,ECOG PS分别为0(63%)或1(37%)。国际转移性肾细胞癌数据库(IMDC)风险组的患者分布为21%有利,62%为中等,16%为差。
主要的疗效结果指标是无进展生存期(PFS),通过RECIST v1.1的BICR评估,通过临床试验评估PD-L1阳性肿瘤患者的总生存期(OS)(PD-L1表达水平≥1%)。由于PFS在pd-l1阳性肿瘤患者中具有统计学意义[HR 0.61(95% CI: 0.48,0.79)],然后在ITT人群中进行检测,在ITT人群中PFS也有统计学意义的改善。
中位总生存期随访为19个月,总生存期数据不成熟,ITT人群中有27%的死亡。
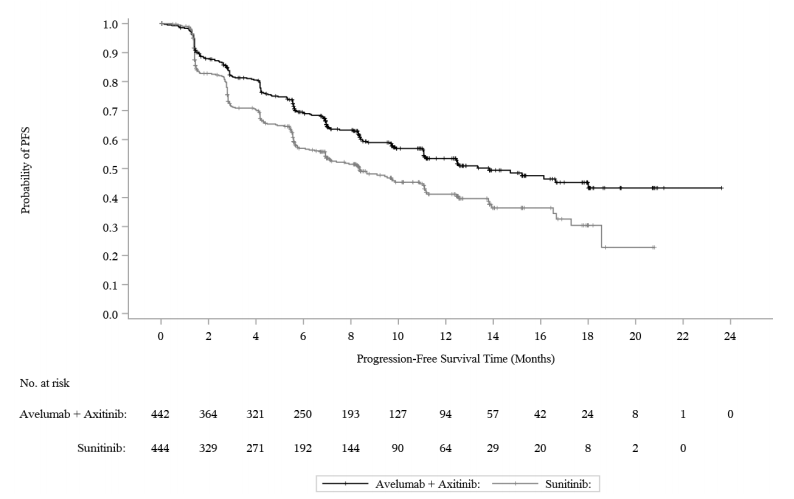
疗效结果见下图和下表。
表:JAVELIN Renal 101试验的疗效结果-ITT
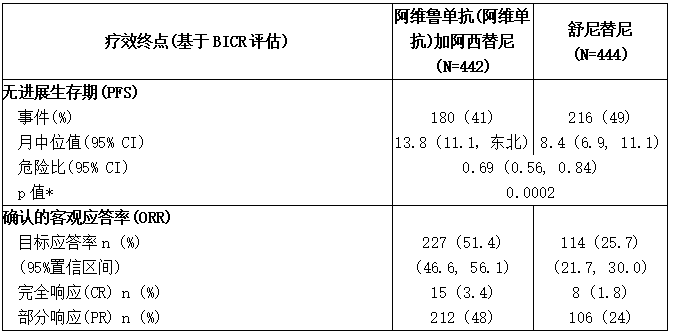
BICR:盲法独立中心审查;CI:置信区间;NE:不可估计。
*基于双侧分层对数秩的p值。
图:基于BICR评估-ITT的PFS的K-M估计值



互联网药品信息服务资格证书

孟加拉耀品国际授权书

孟加拉珠峰制药授权书

孟加拉伊思达制药授权书

孟加拉伊思达制药授权书

土耳其医院授权书
 正品保障
正品保障
 厂家直采
厂家直采
 专业药师
专业药师
 品类齐全
品类齐全