



Tivdak是美国食品药品监督管理局(FDA)批准的首款治疗宫颈癌的抗体偶联药物,也是全球首个获批靶向组织因子的抗体偶联药物,为复发或转移性宫颈癌患者提供了新的治疗选择。
2021年9月20日,由Seagen和Genmab公司联合开发的ADC-Tivdak获FDA批准上市,用于治疗化疗期间或化疗结束后疾病进展的复发或转移性宫颈癌,商品名为Tivdak,剂型为注射剂,规格为40mg。
Tivdak是通过可裂解的连接子将靶向组织因子(TF)的全人源化IgG1-kappa单克隆抗体与微管阻断剂甲基澳瑞他汀E(MMAE)进行偶联而成。Tivdak可通过多种机制发挥抗肿瘤作用:
1、首先,Tivdak与TF结合,产生的复合物内化并被转运到溶酶体,连接子被酶切,释放MMAE到靶细胞中,随后,MMAE与微管蛋白结合并干扰微管聚合,导致G2/M细胞周期阻滞和细胞凋亡;同时,MMAE可扩散至肿瘤微环境,发挥旁观者效应;
2、Tivdak通过激活肿瘤微环境中的巨噬细胞和树突状细胞启动先天性和适应性免疫反应,最终发挥抗肿瘤作用;
3、Tivdak还可与自然杀伤细胞和巨噬细胞表面的FcγR Ia结合,对表达TF的肿瘤细胞产生抗体依赖性细胞毒性作用和吞噬作用;
4、Tivdak还可抑制由FVIa引起的TF相关信号通路激活,进一步增强抗肿瘤效果。
InnovaTV 204[1]是一项II期临床研究(NCT-03438396),旨在评估Tivdak在复发或转移性宫颈癌患者中的疗效和安全性。结果表明,接受Tivdak治疗的患者ORR为24%,其中7%获得完全缓解(CR),17%获得部分缓解(PR) ,疾病控制率(DCR )为72%, 79%的患者病变较基线减少,mDOR为8.3个月(高于目前单药化疗的2~6个月),中位反应时间(mTTR)为1.4个月,mPFS为4.2个月,mOS为12.1个月。
正是基于以上研究结果,FDA加速批准了Tivdak的上市,将其用于治疗化疗期间或之后疾病进展的复发或转移性宫颈癌患者。
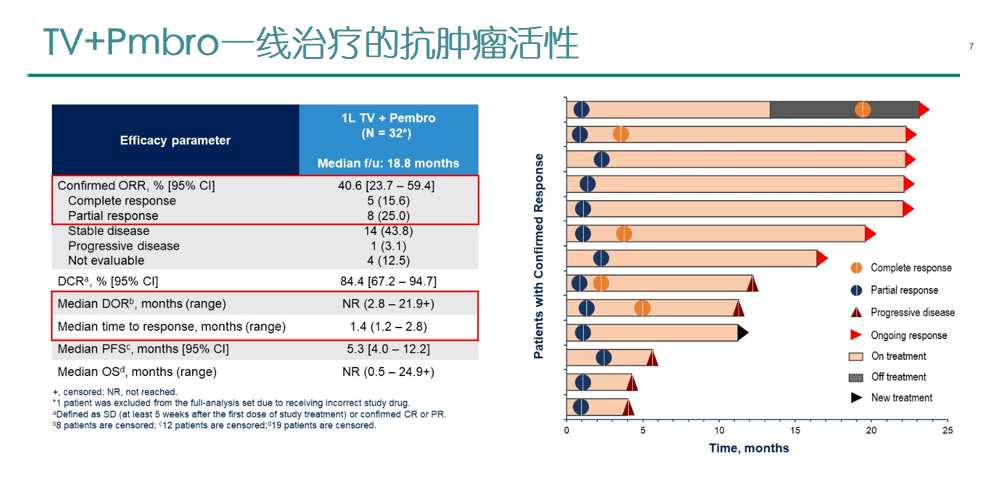
InnovaTV 205是一项全球、多中心、开放的I /II期临床研究(NCT03786081),旨在评估TV单药或与贝伐珠单抗、帕博利珠单抗、卡铂联合对未治疗和既往治疗过的复发或转移性宫颈癌患者的安全性和抗肿瘤活性。
2021 年欧洲肿瘤内科学会.上, 研究者公布了其中两个队列的中期数据:
1、在队列D(Tivdak+卡铂)中,33例既往未进行全身治疗的复发或转移性宫颈癌患者接受了Tivdak(2 mg·kg-1,每3周1次,iv)和卡铂(AUC=5,每3周1次,iv)联合治疗,中位随访4.8个月时,ORR为55%(n=18) ,包括2例CR和16例PR, mDOR为5.6个月,mTTR为1.4个月,mPFS为6.9个月。
2、在队列F(Tivdak+帕博利珠单抗)中,35例既往接受1 ~2次全身治疗期间或之后发生疾病进展的复发或转移性宫颈癌患者接受了Tivdak(2 mg·kg-1 ,每3周1次,iv )和帕博利珠单抗(200 mg,每3周1次,iv)联合治疗,其中,81.5%的患者PD-L1阳性,并且74.3%的患者既往接受过一线治疗,51.4%接受过贝伐珠单抗治疗,在中位随访10.2个月时,ORR为35%,包括2例CR和10例PR,mTTR为1.4个月, mPFS为5.6个月。
综上,Tivdak联合卡铂作为既往未接受过全身治疗的复发或转移性宫颈癌患者的一线治疗方案,以及Tivdak联合帕博利珠单抗作为复发或转移性宫颈癌患者的二线或三线疗法,皆具有令人鼓舞且持久的抗肿瘤活性。
Tivdak是首个且唯一获得FDA批准的二线治疗复发或转移性宫颈癌患者的ADC,也是全球首款靶向TF的ADC,它的成功上市不仅可改变晚期宫颈癌患者的治疗结局,同时也将为Seagen等公司创造巨大的商业价值。目前,除复发或转移性宫颈癌外,Tivdak单药或与其他药物的组合策略也正在多种实体瘤中积极开展临床试验,这无疑将为众多肿瘤患者的生存获益带来新的选择和希望。
[1]黄佳,王浩,钟薇等.治疗复发或转移性宫颈癌的抗体偶联药物:Tisotumab Vedotin-tftv[J].肿瘤药学,2022,12(04):428-432.
热文推荐:伊鲁阿克片是治什么病的?
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
