



2018年10月30日,美国食品和药物管理局(FDA)批准帕博利珠单抗(pembrolizumab,Keytruda, 派姆单抗,可瑞达)联合卡铂和紫杉醇或白蛋白结合型紫杉醇成为转移性鳞状非小细胞肺癌(NSCLC)的一线治疗方法。
KEYNOTE-407试验
该批准是基于KEYNOTE-407(NCT02775435)试验的结果,这是一项随机、多中心、双盲、安慰剂对照试验,研究对象为559名转移性鳞状NSCLC患者,不论PD-L1肿瘤表达状况如何,且之前没有接受过转移性疾病的系统治疗。患者按照1:1随机分组,服用200mg帕博利珠单抗或安慰剂,联合卡铂,以及紫杉醇或白蛋白结合型紫杉醇(研究人员选择),3周一个周期,共4个周期,然后服用帕博利珠单抗或安慰剂。患者服用帕博利珠单抗或安慰剂,直到疾病进展、不可接受的毒性或最长24个月。
主要疗效结果指标为总生存期(OS)、无进展生存期(PFS)和总缓解率(ORR),由盲法独立评审进行评估。该试验表明,与安慰剂+化疗组的患者相比,帕博利珠单抗+化疗组的患者在OS、PFS和ORR方面均有显著改善。两组(帕博利珠单抗+化疗组vs安慰剂+化疗组)的中位OS分别为15.9个月和11.3个月(HR 0.64;95%CI:0.49、0.85;p=0.0017);中位PFS分别为6.4个月和4.8个月。ORR分析仅限于最初随机抽取的204名患者。ORR分别为58%和35%(差异23.6%;95%CI:9.9,36.4;p=0.0008)。估计中位缓解持续时间分别为7.2个月和4.9个月。
KEYNOTE-407试验中,接受帕博利珠单抗治疗的患者中,最常见的不良反应(≥20%)是疲劳/乏力、恶心、便秘、腹泻、呕吐、发热、食欲下降、皮疹、咳嗽、呼吸困难、脱发和周围神经病变。

KEYNOTE-021试验
在过去的5年里,帕博利珠单抗已经成为治疗转移性肺癌的基础用药。KEYNOTE-021试验评估了帕博利珠单抗联合化疗治疗晚期非鳞状NSCLC患者的疗效。
KEYNOTE-021的数据显示,晚期NSCLC患者的客观缓解率(ORR)和无进展生存期(PFS)均有显著改善。总体而言,50%接受帕博利珠单抗联合化疗的患者3年时仍存活,而单独接受化疗的患者只有37%。
此外,与单纯化疗相比,帕博利珠单抗联合疗法还降低了29%的死亡风险(HR,0.71;95%CI,0.45-1.12)。帕博利珠单抗联合疗法患者的中位总生存期(OS)为34.5个月,而单纯化疗的患者为21.1个月。
帕博利珠单抗联合疗法的ORR为58%,而单纯化疗的ORR为33%。联合用药,与单纯化疗相比,还将疾病进展或死亡风险降低了46%(HR,0.54;95%CI,0.35-0.83),中位PFS为24.5个月(范围9.7-36.3)对9.9个月(范围6.2-15.2)。
研究人员发现,完成2年帕博利珠单抗联合治疗的患者中,92%在3年时,仍然存活,所有12名患者均出现客观缓解。估计的3年缓解期(DOR)率为100%(中位DOR未达到;范围11.7+至49.3+个月)。
临床招募
目前,一项国际临床试验——化疗+/-帕博利珠单抗作为可切除非小细胞肺癌围手术期的治疗(KEYNOTE-671)的试验,正在进行临床招募,具体信息如下:
试验目的:
比较铂类双药化疗联合或者不联合帕博利珠单抗作为新辅助/辅助疗法用于可切除的IIB或IIIA期非小细胞肺癌(NSCLC)患者的无事件生存期( EFS )和总生存期(OS)。并比较主要病理学缓解率(mPR),已切除原发肿瘤和淋巴结的病理完全缓解(pCR)率,总体健康状况/生活质量( QOL ),以及受试者的安全性和耐受性。
试验设计:
试验分类:安全性和有效性 试验分期:3期 设计类型:平行分组 随机化:随机化 盲法:双盲 试验范围:国际多中心试验
入选标准:
1.男性/女性受试者,在签署知情同意书当天年满18岁,既往未接受治疗和病理学证实的可切除的II或IIIA或IIIB期(N2)NSCLC(AJCC 版本8)。淋巴结疾病需要病理学确认,而T3 (肋骨破坏)疾病只需要影像学文件。 2.能够接受方案治疗,包括必要的手术。 3.男性受试者必须同意使用节育措施,详见KN671方案附录3。 4.如果禁欲是受试者的日常生活方式,而且也是受试者首选的避孕方法,则可以被接受。 5.a.) 如果女性受试者未怀孕(见KN671方案附录3),不在哺乳期,并且至少符合以下条件之一,则有资格参加:不是KN671方案附录3定义的具有生育能力的女性(WOCBP):避孕指导和妊娠检测 或b.) 同意遵守KN671方案附录3避孕指导和妊娠试验中避孕指南的WOCBP。 6.受试者提供了本试验的书面知情同意书。
排除标准:
1.在研究治疗首次给药前24小时内尿妊娠试验阳性的育龄期妇女(WOCBP)(见KN671附件3)。如果尿检不能确定为阴性,则需要进行血清妊娠试验。在这种情况下,如果血清妊娠试验的结果为阳性则必须排除受试者。 2.具有下列肿瘤位置/类型之一: ●累及上沟的NSCLC ●大细胞神经内分泌癌(LCNEC) ●肉瘤样肿瘤 3.有需要类固醇治疗的(非感染性)肺炎/间质性肺病的病史,或者当前有需要类固醇治疗的肺炎/间质性肺病。 4.具有需要系统性治疗的活动性感染。 5.接受过同种异体组织/实体器官移植的受试者。 6.已知对帕博利珠单抗,其活性物质和/或任何辅料重度过敏(≥3级)。 (注:以上为部分标准,最终入选由研究人员确定)
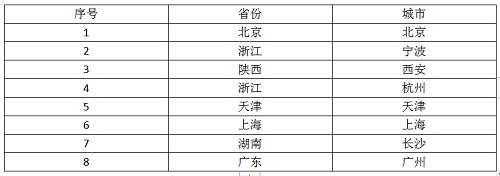
主要研究中心所在地(具体启动情况以后期咨询为准)
如果想了解更多信息,可联系医伴旅团队,我们将为您解惑。联系电话:400-001-2811
参考文献: https://www.fda.gov/drugs/fda-approves-pembrolizumab-combination-chemotherapy-first-line-treatment-metastatic-squamous-nsclc https://www.cancernetwork.com/view/two-studies-examining-pembrolizumab-combinations-induce-positive-outcomes-in-advanced-nsclc
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。



