药品称呼
中文名称:艾萨妥昔单抗
英文名:Isatuximab
商品名:SARCLIS
规格
SARCLISA是一种透明至微乳白色、无色至微黄色的溶液,基本上不含可见颗粒,包括3种剂型:
(1)注射:100mg / 5ml (20mg /mL),单剂量瓶
(2)注射:500mg / 25ml (20mg /mL),单剂量瓶
禁忌
对isatuximab irfc或其任何赋形剂严重过敏的患者禁用SARCLISA。
贮藏
将药箱在36°F至46°F(2°C至8°C)下冷藏,注意避光。不要冷冻。不要摇晃。
作用机制
Isatuximab-irfc是一种CD38靶向的细胞溶解抗体,是嵌合免疫球蛋白G1 (IgG1)单克隆抗体(mAb)。isatuximb -irfc是由哺乳动物细胞系(中国仓鼠卵巢,CHO)使用饲料批量生产工艺生产的。Isatuximab-irfc由两个相同的免疫球蛋白kappa轻链和两个相同的免疫球蛋白gamma重链组成,总体分子量约为148 kDa。
SARCLISA (isatuximab-irfc)注射剂是一种无菌,不含防腐剂,透明到略呈乳白色,无色到略黄色的溶液,在静脉使用的单剂量瓶中基本上不含可见颗粒。每瓶含有100mg / 5ml或500mg / 25ml的isatuximab-irfc,浓度为20mg /mL, pH为6.0。每毫升溶液含有20mg isatuximab-irfc、组氨酸(1.46 mg)、一水组氨酸盐酸盐(2.22 mg)、聚山梨酯80 (0.2 mg)、蔗糖(100 mg)和注射用水。
安全与疗效
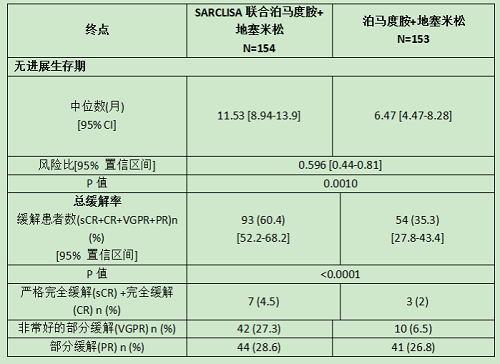
(1)ICARIA-MM (NCT02990338)试验评估了SARCLISA联合泊马度胺和地塞米松(Isa-Pd)的有效性和安全性,这是一项多中心、多国界、随机化、开放标签、2组对照的3期临床试验,研究对象为复发和/或难治性多发性骨髓瘤患者。这些患者之前至少接受过两种治疗,包括来那度胺和蛋白酶体抑制剂。符合条件的患者为:ECOG)评分为0-2、血小板≥75,000 cells/mm3、绝对中性粒细胞计数≥1 × 109/L、肌酐清除率≥30 mL/min/1.73 m2 (MDRD公式)、AST≤3 ×ULN、ALT≤3×ULN。
307例患者按1:1的比例随机接受SARCLISA联合泊马度胺和地塞米松(Isa-Pd, 154例)或泊马度胺和地塞米松(Pd, 153例)。两组均以28天为一个周期进行治疗,直到疾病进展或出现不可接受的毒性。SARCLISA在第一个周期的每周以及随后周期每2周以 10 mg/kg的剂量静脉滴注给药。泊马度胺在每个28天周期的第1天到第21天口服,每天4 mg。地塞米松在每个28天周期的第1、8、15和22天口服或静脉注射给药,剂量为40 mg(年龄≥75岁的患者20 mg)。
总体而言,两组患者基线时的人口学和疾病特征相似。患者中位年龄为67岁(范围36-86),20%的患者年龄≥75岁;79%的患者是白人,12%是亚洲人,1%是黑人或非洲裔美国人;10%的患者有COPD或哮喘病史。肾损害(肌酐清除率<60 mL/min/1.73 m2)患者比例为34%。在研究开始时,国际分期系统(ISS)分期为I期的患者占37%,II期患者占36%,III期患者占25%。总体而言,在研究开始时,20%的患者有高危染色体异常;Del (17p)、t(4;14)和t(14;16)分别在12%、8%和2%的患者中存在。
既往治疗次数的中位数为3次(范围2-11)。所有患者之前都接受过蛋白酶体抑制剂、来那度胺,56%的患者之前接受了干细胞移植;大多数患者(93%)对来那度胺耐药,76%对蛋白酶体抑制剂耐药,73%对免疫调节剂和蛋白酶体抑制剂均耐药。
Isa-Pd组的中位治疗持续时间为41周,而Pd组为24周。
SARCLISA的疗效评估是基于无进展生存期(PFS)。PFS结果由一个独立的反应委员会根据中央实验室的m蛋白数据和采用国际骨髓瘤工作组(IMWG)标准的中央影像学评价进行评估。在接受Isa-Pd治疗的患者中,PFS的改善表明疾病进展或死亡风险降低了40%。
Isa-Pd组第一次缓解的中位时间为35天,而Pd组为58天。IsaPd组的中位缓解持续时间为13.3个月(95% CI: 10.6-NR),而Pd组为11.1个月(95% CI: 8.5-NR)。两组患者的中位总生存期均未达到。中位随访时间为11.6个月,Isa-Pd组43例(27.9%)患者死亡,Pd组56例(36.6%)患者死亡。中期分析时OS结果无统计学意义。
疗效对比见下表:
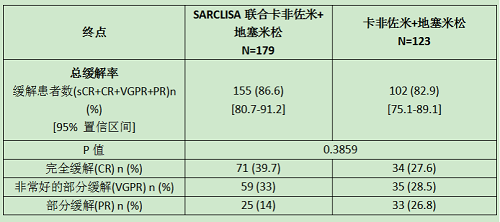
(2)IKEMA (NCT03275285)试验对SARCLISA联合卡非佐米和地塞米松的有效性和安全性进行了评估。这是一项多中心、多国界、随机化、开放标签、2组对照的3期临床试验,研究对象为复发和/或难治性多发性骨髓瘤患者。这些患者前期接受了一到三种治疗方案。符合条件的患者为:ECOG评分为0-2、血小板≥50,000 cells/mm3、绝对中性粒细胞计数≥1× 109/L、肌酐清除率≥15 mL/min/1.73 m2 (MDRD公式)、AST≤3×ULN、ALT≤3×ULN。
302例患者按3:2的比例随机接受SARCLISA联合卡菲佐米和地塞米松(Isa-Kd, 179例)或卡菲佐米和地塞米松(Kd, 123例)。两组均以28天为一个周期进行治疗,直到疾病进展或出现不可接受的毒性。SARCLISA在第一个周期的每周以及随后周期每2周以 10 mg/kg的剂量静脉滴注给药。卡菲佐米的给药:第1、2天静脉滴注20mg /m2 ; 第1个周期的第8、9、15、16天56 mg/m2 ; 随后每个28天周期的第1、2、8、9、15、16天剂量为56 mg/m2。地塞米松在每个28天周期的第1,、2、 8、 9、 15、 16、 22和23天以20 mg的剂量给药(在isatuximab-irfc和/或卡非佐米输注的同一天注射给药,或者是在其他时间口服)。在同时给予SARCLISA和卡非佐米的时候,先给予地塞米松,然后输注SARCLISA,再输注卡非佐米。
总体而言,两组患者基线时的人口学和疾病特征相似。患者中位年龄为64岁(33-90岁),9%≥75岁,71%为白人,17%为亚洲人,3%为黑人或非裔美国人。Isa-Kd组患者出现肾损害(eGFR<60 mL/min/1.73 m2)的患者比例为24%,Kd组为15%。在研究开始时,国际分期系统(ISS)分期为I期的患者占53%,II期的患者占31%,III期的患者占15%。总体而言,24%的患者在研究开始时有高危染色体异常;Del (17p)、t(4;14)、t(14;16)分别在11%、14%和2%的患者中存在。此外,42%的患者出现增益(1q21)。
既往治疗次数的中位数为2(范围1-4),44%的患者曾接受过1次前期治疗。总的来说,90%的患者接受了蛋白酶体抑制剂治疗,78%的患者接受了免疫调节剂治疗(包括43%的患者接受了来那度胺治疗),61%的患者接受了干细胞移植治疗。总体而言,33%的患者对之前的蛋白酶体抑制剂难治,45%的患者对之前的免疫调节剂难治(包括33%的来那度胺难治),21%的患者对蛋白酶体抑制剂和免疫调节剂都难治。
Isa-Kd组的中位治疗持续时间为80周,Kd组为61周。
SARCLISA的疗效评估是基于PFS。PFS结果由独立反应委员会根据中央实验室的m蛋白数据和采用IMWG标准的中央影像学复查评估。与Kd治疗的患者相比,采用Isa-Kd治疗的患者PFS的改善意味着疾病进展或死亡的风险降低了45%。
疗效对比见下表:
【完整说明书详见】:https://nctr-crs.fda.gov/fdalabel/ui/search













 正品保障
正品保障
 厂家直采
厂家直采
 专业药师
专业药师
 品类齐全
品类齐全









