



艾萨妥昔单抗(Isatuximab)对于多发性骨髓瘤(MM)的效果明显。最新研究表明,接受艾萨妥昔单抗(Isatuximab)联合泊马度胺和地塞米松治疗的MM患者中位无进展生存期为11.5个月,客观缓解率为60.4%(93/154),常见不良反应有中性粒细胞减少、血小板减少和贫血等。
艾萨妥昔单抗(Isatuximab)是由赛诺菲公司开发的IgG1单克隆抗体,可与造血细胞和肿瘤细胞[包括多发性骨髓瘤(MM)细胞]表面表达的CD38结合,通过多种生物学机制发挥抗肿瘤作用,如抗体依赖细胞介导的细胞毒作用和补体依赖的细胞毒作用等。
2020年3月2日,美国食品和药物管理局(FDA)批准艾萨妥昔单抗(Isatuximab)联合泊马度胺和地塞米松(Isa-Pom-Dex)用于治疗既往至少接受过2种药物(包括来那度胺和1种蛋白酶体抑制剂)治疗的MM成人患者。
大量研究证明,艾萨妥昔单抗(Isatuximab)联合泊马度胺和地塞米松治疗多发性骨髓瘤及复发难治性多发性骨髓瘤均具有良好的疗效,不良反应可控且耐受性较好。
背景:艾萨妥昔单抗(Isatuximab)是一种结合人CD38受体特异性表位的单克隆抗体,通过多种作用机制具有抗肿瘤活性。在之前的1b期研究中,约65%的复发和难治性多发性骨髓瘤患者通过艾萨妥昔单抗(Isatuximab)联合泊马度胺(pomalidomide)和低剂量地塞米松获得了总体缓解。
研究的目的是在复发和难治性多发性骨髓瘤患者中,确定艾萨妥昔单抗(Isatuximab)联合pomalidomide和地塞米松与pomalidomide和地塞米松相比的无进展生存期益处。
方法:在欧洲、北美和亚太地区24个国家的102家医院进行了一项随机、多中心、开放标签的3期研究。将患者随机(1:1)分配到10 mg/kg的艾萨妥昔单抗(Isatuximab)加4 mg泊马度胺加40 mg地塞米松组或4 mg泊马度胺加40 mg地塞米松组。使用交互反应技术进行随机分组,并根据既往治疗线的数量和年龄进行分层。
根据区块大小为4的置换区块随机化方案分配治疗。艾萨妥昔单抗(Isatuximab)-pomalidomide-地塞米松组在第一个28天周期的第1、8、15和22天静脉注射艾萨妥昔单抗(Isatuximab),然后在随后周期的第1和15天静脉注射艾萨妥昔单抗(Isatuximab)。两组在每个周期的第1-21天接受口服泊马度胺,在每个周期的第1、8、15和22天接受口服或静脉注射地塞米松。治疗持续到疾病进展、不可接受的毒性或同意撤销。pomalidomide和地塞米松允许减少不良反应的剂量,但艾萨妥昔单抗(Isatuximab)不允许。主要终点是无进展生存期。
结果:在2017年1月10日至2018年2月2日之间,随机分配307名患者进行治疗,154名患者接受艾萨妥昔单抗(Isatuximab)-泊马度胺-地塞米松治疗,153名患者接受泊马度胺-地塞米松治疗。在中位数为11±6个月的随访中,艾萨妥昔单抗(Isatuximab)-pomalidomide-地塞米松组的中位无进展生存期为11±5个月,而pomalidomide-地塞米松组为6±5个月。最常见的治疗中出现的不良事件为输注反应、上呼吸道感染和腹泻。
由此得出结论,在泊马度胺-地塞米松治疗的基础上加用艾萨妥昔单抗(Isatuximab)可显著提高复发和难治性多发性骨髓瘤患者的无进展生存率。艾萨妥昔单抗(Isatuximab)是治疗复发和难治性骨髓瘤的一种重要的新治疗选择,特别是对于对来那度胺和蛋白酶体抑制剂耐药的患者。
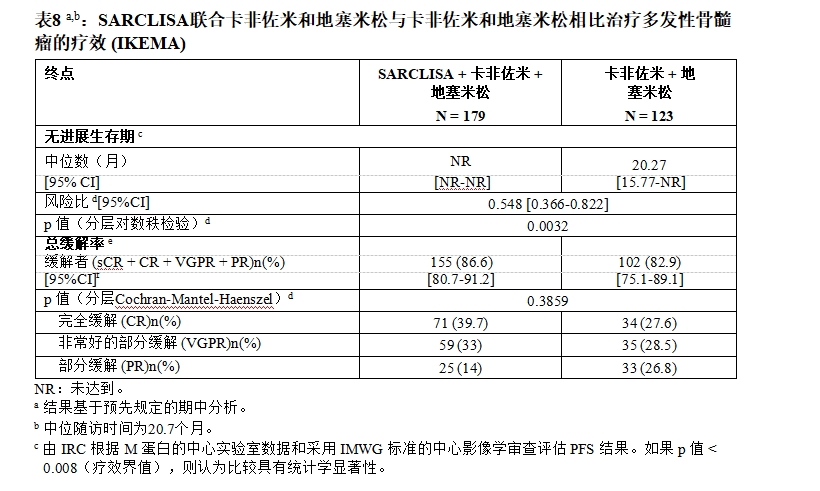
对于多发性骨髓瘤患者,艾萨妥昔单抗(Isatuximab)的推荐剂量为10mg/kg实际体重,静脉输注给药。与泊马度胺和地塞米松联用或与卡非佐米和地塞米松联用。艾萨妥昔单抗(Isatuximab)第1周期的第1、8、15和22天给药,第2周期及以后每1、15天给药,每个治疗周期为28天。重复治疗,直至疾病进展或出现不可接受的毒性。
对于与艾萨妥昔单抗(Isatuximab)和泊马度胺联合给药,地塞米松40mg口服或静脉给药(或对于≥75岁的患者,20mg口服或静脉给药)。
综上,艾萨妥昔单抗(Isatuximab)在治疗多发性骨髓瘤方面显示出显著的效果和良好的安全性,为这种血液恶性肿瘤的治疗提供了新的选择。
[1]汪龙,陆松伟,周宁宁等.治疗多发性骨髓瘤新药:抗CD38单克隆抗体isatuximab[J].中国新药与临床杂志,2021,40(01):18-21.DOI:10.14109/j.cnki.xyylc.2021.01.04.
相关热文推荐:骨质疏松新药Romosozumab的效果好吗?
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。
