



2023年1月16日,美国FDA批准PD-1抑制剂帕博利珠单抗(Keytruda,K药)作为单药辅助疗法,治疗经手术切除与铂类化疗后的IB、II、IIIA期非小细胞肺癌(NSCLC)成人患者。 这是K药在美国获批的第34项适应症。帕博利珠单抗是一种选择性、人源化、单克隆抗PD-1抗体,可破坏PD-1与其配体程序性死亡受体-配体1(PD-L1)之间的相互作用,从而激活并扩增细胞毒性T细胞以促进免疫介导的抗肿瘤作用。
此次帕博利珠单抗新适应证批准主要是基于KEYNOTE-091 研究III期临床试验结果。主要研究终点是无疾病生存期(DFS)。
KEYNOTE-091临床试验设计:
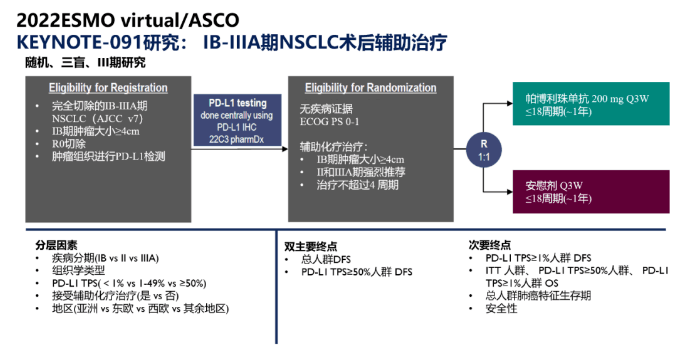
研究结果显示,在手术切除后接受铂类辅助化疗的患者中,与安慰剂组相比,Keytruda能够减少患者疾病复发或死亡风险达27%(HR=0.73,95% CI:0.60-0.89),无论患者的PD-L1表达量为何。Keytruda组患者的中位DFS将近5年(58.7个月),而安慰剂组患者则仅近2年(23.8个月)。在167位未曾接受化疗辅助疗法的探索性病患亚群中(14%),其DFS的HR为1.25(95% CI:0.76-2.05)。
在KEYNOTE-091试验中,病患所出现的不良反应与过去接受Keytruda作为单剂疗法的NSCLC患者类似,除了分别有22%、11%、7%患者发生甲状腺功能减退、甲状腺功能亢进与肺炎。另外有两起致死性心肌炎产生。
相关热文推荐:帕博利珠单抗用于鳞癌效果如何?
注:文章信息来源于网络,仅供医护人员内部讨论,不作为用药依据,具体用药指引,请咨询主治医师。



